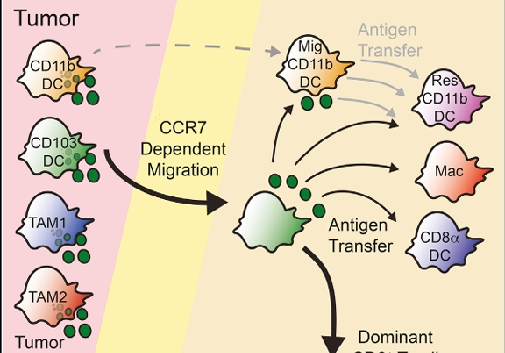
肿瘤微环境中的树突状细胞(DC)在启动T细胞免疫应答中发挥关键作用。
引言
近年来,癌症免疫治疗领域取得显著进展,其中树突状细胞(DC)在肿瘤抗原递呈和T细胞激活中的关键作用备受关注。2016年发表于《Cancer Cell》的一项研究揭示了CD103⁺(小鼠)或CD141⁺(人类)树突状细胞通过CCR7依赖性迁移机制,将肿瘤抗原转运至引流淋巴结(dLN),从而启动CD8⁺ T细胞免疫应答的重要机制。这一发现为理解肿瘤微环境中免疫细胞的动态调控提供了新视角。
CD103⁺/CD141⁺ DC是肿瘤抗原转运的主导者
研究团队通过多种实验模型(如表达荧光蛋白mCherry的B78ChOVA黑色素瘤模型和自发型PyMTChOVA乳腺癌模型)发现,肿瘤微环境中的CD103⁺ DC是携带抗原至dLN的主要细胞类型。流式细胞术和共聚焦显微镜显示,约10%-15%的dLN中CD103⁺ DC含有肿瘤源性mCherry荧光信号,而其他髓系细胞(如CD11b⁺ DC或巨噬细胞)的抗原携带比例显著较低。此外,通过遗传标记技术(Ubc-CreERT2 mTmG小鼠)证实,CD103⁺ DC的迁移依赖于G蛋白信号通路,且这一过程在自发性肿瘤模型中同样存在,排除了人工注射模型的局限性。
CCR7是抗原转运与T细胞激活的核心调控因子
进一步研究发现,CD103⁺ DC高表达趋化因子受体CCR7,其介导的迁移对肿瘤抗原递呈至关重要。在CCR7缺陷小鼠中,CD103⁺ DC无法有效迁移至dLN,导致肿瘤抗原递呈缺陷和CD8⁺ T细胞激活受阻。通过混合骨髓嵌合体实验,研究者明确证实:CCR7在CD103⁺ DC中的特异性表达(而非其他细胞)是T细胞在dLN中激活的必要条件。此外,使用pH稳定性荧光蛋白ZsGreen的实验表明,CCR7还参与抗原从迁移性DC向淋巴结驻留性APC(如CD8α⁺ DC)的"递送"过程,从而扩大抗原提呈范围。
人类肿瘤中的临床相关性
在人类黑色素瘤中,CD141⁺ DC(相当于小鼠CD103⁺ DC)同样高表达CCR7。通过对临床数据库的分析,研究者发现肿瘤组织中CCR7表达水平与CD8⁺ T细胞浸润程度呈正相关,且高CCR7表达患者的总生存期显著延长。这一结果提示,CCR7-CD141⁺ DC轴可能是人类肿瘤免疫监测的重要机制,其功能状态可能影响免疫治疗的疗效。
治疗意义与未来方向
该研究揭示了肿瘤微环境中持续存在的天然免疫激活途径,为联合治疗策略提供了理论依据。例如,增强CCR7信号(如通过免疫复合物或放疗诱导抗原释放)可能促进DC迁移,从而提升检查点抑制剂(如抗CTLA-4/PD-1)的疗效。此外,针对CD103⁺/CD141⁺ DC的靶向激活或过继性回输,有望成为增强抗肿瘤T细胞应答的新方法。
结论
这项研究阐明了CD103⁺/CD141⁺ DC通过CCR7依赖性机制桥接肿瘤抗原递呈与T细胞激活的分子基础,为开发基于DC的癌症免疫疗法提供了重要线索。未来需进一步探索如何优化这一通路,以克服肿瘤免疫逃逸并改善临床预后。
不感兴趣
看过了
取消

人点赞

人收藏

打赏
不感兴趣
看过了
取消

打赏金额
认可我就打赏我~
1元 5元 10元 20元 50元 其它
打赏作者
认可我就打赏我~
扫描二维码
立即打赏给Ta吧!
温馨提示:仅支持微信支付!
已收到您的咨询诉求 我们会尽快联系您
