功能亲和力;结构亲和力
如上期《全面认识T细胞免疫》所述,CD8+ T细胞通过TCR与其相应的pMHC配体结合特异性地识别其靶标。此过程启动了一种胞内信号级联反应,导致T细胞发挥效应功能。因此,CD8+ T细胞在清除病毒感染或对抗恶性细胞中起着关键作用。但不仅仅是特定T细胞的数量似乎很重要。越来越多的研究支持这样一个假设,即CD8+ T细胞的质量在其效应反应的效率中起着决定性的作用。
T细胞亲和力定义
T细胞的质量通常用T细胞亲和力来描述,这可以定义为T细胞对遇到抗原的反应效率。亲和力主要是通过测定诱导T细胞增殖或效应功能所需的肽配体量来测量的。因此,能够识别呈现低量肽的靶标细胞的T细胞被称为高亲和力T细胞,而只有在高量肽存在下才作出反应的T细胞则被称为低亲和力T细胞。对不同肽敏感性的了解改变了激活和扩增细胞毒性T细胞的方法:以前,为了获得更强的CTL反应,会使用逐渐增加的肽量。但这些强烈的反应主要依赖于大量肽特异性T细胞的激活。后来研究表明,不仅被激活的T细胞数量,而且诱导的T细胞质量也在CTL反应效率中起着重要作用,因此,T细胞对肽配体的差异敏感性已被用于在体外扩增具有特定亲和力的细胞。自次,在病毒系统和肿瘤系统中都已证明高亲和力T细胞具有更高的效力。
T细胞亲和力和耐受性
虽然高反应性的T细胞被认为对抵抗病原体或恶性细胞的免疫反应有益,但当它们识别宿主成分时,可能会变得有害,导致严重的组织损伤和自身免疫。为防止这种情况,已经进化出多种机制来诱导T细胞对机体组织的耐受性。
中央耐受
αβ T细胞的发育依赖于在胸腺中与自身MHC分子的相互作用。自身抗原MHC复合物由骨髓来源的DC呈递。这些细胞能够在其表面呈递内源性和外源性表达的抗原,通过一种称为交叉呈递的机制从吞噬体区室获取抗原。除了DC,胸腺上皮细胞(TEC)也在胸腺中的抗原呈递中起重要作用。TEC表达自身免疫调节因子(AIRE)基因,这使它们能够合成并表达许多外围组织抗原,否则这些抗原在胸腺中是不可用的。
在所谓的阳性选择中,胸腺细胞必须识别与自身MHC分子结合的抗原,以确保这些细胞能够产生免疫反应。这种相互作用不仅拯救胸腺细胞免于凋亡,还诱导它们分化为成熟的T细胞。接下来,在称为克隆删除的过程中,具有自身反应性受体的T细胞必须被消除,以防止自身反应性T细胞的成熟(阴性选择)(图1.4)。这两种自我MHC限制和自我耐受的途径都是由TCR与MHC-自身-肽复合物的结合启动的,但导致的结果完全不同。这些表面上相似的事件是如何区分开来的?

图1.4 从胸腺细胞中选择成熟的T细胞:表达高亲和力自身肽-MHC配体的TCR的CD4+CD8+双阳性(DP)胸腺细胞会发生凋亡(阴性选择),而识别低亲和力自身肽-MHC配体的DP细胞则分化为CD4+或CD8+单阳性(SP)胸腺细胞(阳性选择)。外周T细胞库在经过阳性和阴性选择后,既受到自身MHC限制,又具有自身耐受性。
为了解释这些差异,提出了两种假设:在定性信号假设中,TCR传递的信号性质起决定性作用。正向选择和负向选择由不同的pMHC复合物诱导,导致因TCR构象或空间变化或相关分子对信号传导的调节而产生的定性不同的信号。相比之下,亲和力假设认为,TCR与pMHC结合的结果取决于受体和共受体传递信号的强度。这种结合强度又依赖于TCR对pMHC复合物的亲和力以及该复合物在胸腺皮质上皮细胞上的密度。弱信号会拯救胸腺细胞免于凋亡并对其进行正向选择,而强信号则导致凋亡,从而进行负向选择。研究表明,TCR对呈递的pMHC非常微小的亲和力差异就足以改变发育中的胸腺细胞的命运。信号传导的亲和力模型包括例如动力学校验模型和区分模型。在这些模型中,由于信号传导过程的复杂性或完整(正向)与不完整(负向)信号的比例,很小的亲和力差异能够引发显著不同的结果。
外周耐受
中央耐受机制导致高亲和力识别自身pMHC复合物的T细胞被消除。但由于多种原因,外周还需要额外的耐受机制以完全防止自身免疫。首先,必须避免对通过饮食或环境获得的无害环境抗原产生免疫反应。其次,中央耐受并不完全,因为并非所有抗原都在胸腺中通过AIRE的活性表达。第三,低亲和力识别自身pMHC复合物的T细胞不会通过阴性选择被清除,并应在外周保持无知状态。然而,刺激微环境的变化可以激活这些T细胞并打破其无知状态。对潜在自反应性T细胞的耐受诱导依赖于不同的机制:调节性T细胞(Treg)的抑制作用、抗原呈递DCs的活化状态以及抗原的持续存在。
天然存在的Tregs除了表达CD4外,还表达高亲和力IL-2受体α链(CD25),因为它们的生长和存活严格依赖于IL-2的存在。CD4+CD25+ Tregs在胸腺中发育,并表现出多样化的TCR库。在胸腺选择过程中,CD4+CD25+ Tregs的发育需要其TCR与皮质上皮细胞表达的自身pMHC分子之间具有更高的亲和力相互作用,这比正常正向选择所需的要求更高。这导致了一种假设,即低亲和力相互作用会导致T细胞存活,高亲和力相互作用会导致负向选择,而中间亲和力相互作用则会促进调节性T细胞的发育。Tregs被认为通过分泌包括TGF-β和IL-10在内的细胞因子以及通过直接的细胞间接触来发挥作用。因此,Tregs对那些与相同抗原呈递细胞上的pMHC结合具有高亲和力的T细胞产生影响。最终,研究还表明Tregs能够改变抗原呈递细胞的功能,使其无法激活T细胞。
DC细胞在外周获取抗原,并随后将其呈递给在二级淋巴器官中循环的T细胞。高亲和力识别所呈递抗原的T细胞可以因此被激活。然而,在没有病原体的情况下,DC细胞仅表达低水平的共刺激分子,如B7.1或B7.2,这些分子与T细胞上的CD28相互作用。T细胞在没有通过CD28共刺激的情况下高亲和力识别抗原,只会导致短暂的增殖期和减弱的效应功能。最终,T细胞耐受性通过T细胞的删除或无能而诱导。
免疫反应中的T细胞亲和力
要在胸腺中经历阳性选择,TCR必须以足够的亲和力与MHC复合物结合。在外周,T细胞通过TCR识别抗原pMHC而被激活,并引发免疫反应。这表明TCR-配体结合不同于大多数蛋白质-蛋白质相互作用的常见模式,因为单个TCR可以与许多不同的配体结合。抗原肽/MHC配体的不同变体可以诱导截然不同的T细胞反应,这导致这些配体被分类为TCR的部分激动剂或拮抗剂。在大多数情况下,生物和临床过程的谱型与TCR和相应pMHC配体之间的结合强度相关。因此,对TCR具有更高亲和力的配体在诱导免疫反应方面更为优越。下面总结了目前对T细胞亲和力在T细胞反应不同方面影响的认识。
T细胞活化和募集
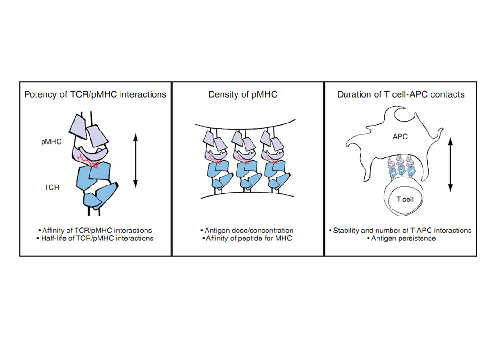
TCR-pMHC相互作用是否导致完全的T细胞活化似乎强烈依赖于配体与TCR之间的亲和力。如前文所述,动力学校正模型和动力学区分模型试图解释TCR-配体亲和力的微小差异如何导致不同的结果。它们指的是TCR-配体相互作用的持续时间,这是T细胞承诺进行完全活化事件所必需的。图1.5展示了影响TCR-pMHC相互作用强度的多个因素。

图1.5 影响TCR活化强度的因素:多个参数共同作用于TCR刺激的强度:TCR-pMHC相互作用的生化参数,如亲和力和半衰期,pMHC配体的密度,以及时间成分,包括T细胞与抗原提呈细胞相互作用的持续时间和抗原持久性。
根据这些动力学模型,与TCR亲和力低的配体,因此TCR解离速度快,只能引发早期T细胞活化事件,但不允许T细胞进行后期的活化事件。因此,低亲和力的TCR-配体相互作用只会导致不完全的T细胞反应,甚至可能完全抑制它。然而,更长时间的TCR相互作用会促进完整的T细胞活化,从而实现成功的T细胞反应。这一假设的基本概念是,形成完全功能的信号复合物需要最低限度的时间,这使得T细胞能够区分低亲和力和高亲和力配体。
几项研究详细探讨了早期激活事件的差异。监测早期T细胞激活的一种方法是在TCR-配体相互作用后测量细胞内Ca2+浓度。如果这种相互作用相对较短,Ca2+浓度的增加会延迟。在对肿瘤反应性T细胞的更详细研究中,高亲和力配体的相互作用诱导了持续的Ca2+外流和内质网中储存的Ca2+完全耗尽。然而,低亲和力TCR-配体相互作用导致了波动的Ca2+外流和储存的Ca2+部分耗尽。CD3ζ向免疫突触的募集也是早期T细胞激活的一个指标。研究表明,较短的TCR-配体相互作用后,这一募集过程被延迟。然而,如果观察突触的时间较长,则积累了相似水平的CD3ζ。其他研究也表明,弱pMHC配体的相互作用会导致延迟但往往可比的反应,只要给予足够的时间。体内研究揭示了不同病原体剂量下T细胞激活的差异如何影响具有不同亲和力的T细胞克隆招募到免疫反应中。在免疫反应的早期阶段,活化的T细胞的TCR多样性与初始库相当。然而,在免疫反应的高峰时期,TCR库转向更高亲和力的克隆。进一步的数据证实,低亲和力TCR-配体相互作用在体内导致早期T细胞激活,但经历提前收缩。此外,在李斯特菌感染模型中显示,抗原特异性T细胞的功能亲和力在二次感染中高于初次感染。这种效应与二次感染中T细胞库聚焦于更高亲和力的TCRs相关。综上所述,这些研究表明,免疫系统通过优先招募高亲和力T细胞克隆来最大化其对入侵病原体的反应。值得注意的是,即使在低病原体剂量下,高亲和力克隆的参与也非常高效。
肽特异性
要引发任何T细胞活化(完全或不完全),TCR-pMHC相互作用必须达到TCR结合的最低阈值。TCR的肽特异性可以强烈影响这种相互作用的结果,因为肽序列中的微小变化可能会降低结合亲和力,并导致相互作用能量低于最低阈值。在此背景下,低亲和力TCR的T细胞似乎更为特异,因为肽序列的微小改变可能导致T细胞活化的完全丧失。然而,高亲和力TCR的T细胞即使在相互作用能量显著减少的情况下仍能被激活,因此能够容忍肽序列中更多的变化。因此,高亲和力TCR表现出较低的肽特异性。在初次免疫反应中,低亲和力TCR显示出对肽的高度特异性优势,但无法识别和消除由病毒突变产生的肽变体。免疫后,整体T细胞亲和力的增加可以被观察到,这可能使免疫系统具备对肽变体作出反应的能力。
保护机制
如前所述,高亲和力T细胞在激活T细胞和启动免疫反应方面更为高效。多项研究表明,这种能力直接影响T细胞对抗病毒感染或肿瘤的保护能力。因此,高亲和力CTL在减少病毒载量方面比相同数量的低亲和力CTL更为有效,尽管两者都能识别靶细胞。即使增加了转移的CTL数量三倍或更多时间,低亲和力CTL仍然无法有效降低病毒负担。有研究发现了两种互补机制来解释这种效率提升:高亲和力CTL不仅更早识别其靶细胞,还更早启动这些细胞的裂解。低亲和力与高亲和力T细胞在体内的不同效果可能归因于识别靶细胞所需的病毒抗原量不同。据推测,在感染早期能够识别并裂解靶细胞的CTL可能比在感染进展后才识别靶细胞的CTL更有效地实现病毒清除。因此,如果低亲和力CTL需要感染细胞表面达到较高抗原密度才能发挥作用,而这些密度只有在新组装的病毒即将释放前才能达到,那么CTL控制感染的可能性较低。此外,低亲和力T细胞表现出裂解活性开始的时间延迟,这可能是由于TCR信号传导效率的内在差异所致。裂解速率相似,但正如前面提到的,延迟的启动使得感染得以进展,从而更难控制。低亲和力与高亲和力T细胞裂解活性开始时间的差异可以用TCR亲和力的不同来解释。启动可能需要一定阈值的TCR分子参与或聚集,或者连续触发。由于可以假设低亲和力T细胞的TCR-pMHC相互作用平均停留时间较短,TCR与其配体的接触时间可能不足以引发有效的TCR信号传导。
总之,高亲和力T细胞对靶细胞的早期识别和消除防止了病毒在细胞内的积累,并使T细胞能够控制感染的进展。
测定T细胞亲和力
前面已经表明,T细胞亲和力是判断T细胞质量的重要参数,因为它对T细胞反应的结果有显著影响。然而,"T细胞亲和力"这一术语常常用于描述完全不同检测系统的实验结果。"功能亲和力"主要通过测量抗原识别的敏感性来确定,即引发T细胞增殖或效应功能所需的肽段量。然而,T细胞亲和力也可以描述为"结构亲和力",其定义为TCR与pMHC分子之间的亲和力,结合共受体CD8或CD4的亲和力。对于功能亲和力和结构亲和力的测量,分别存在几种不同的方法。
功能亲和力测定
T细胞的功能亲和力受多种不同因素的影响。因此,它可以因黏附分子、T细胞信号传导级联或TCR共受体表达的变化而改变。研究表明,T细胞的功能亲和力由CD8αα与CD8αβ的表达所调控。在高亲和力T细胞中,发现了更高的CD8αβ异二聚体表达,这促进了CD8与TCR在脂筏中的共定位。除了CD8,其他分子如LFA、ZAP-70、Lck或TCR的表达水平也有可能影响T细胞的功能亲和力。然而,为了参与成功的T细胞活化,所有这些分子在免疫突触中的正确定位至关重要。因此,通过将膜分子招募到脂筏中实现其最佳定位,可以导致T细胞具有较高的功能亲和力。
功能亲和力的测定主要在体外通过使用负载不同浓度肽段的APCs刺激T细胞来进行。作为读出指标,会测量效应功能,例如IFNγ的产生或肽脉冲细胞的裂解。
1)细胞内细胞因子染色(ICS)
在多种确定T细胞产生细胞因子的方法中,胞内细胞因子染色(ICS)是除了ELISA和ELISpot测定法之外最常用的一种方法。通过固定和透化方法与直接标记的单克隆抗细胞因子抗体结合,ICS能够检测抗原特异性T细胞。首先,目标细胞通过抗原特异性刺激方式激活,例如与肽脉冲处理的APCs孵育以诱导细胞因子产生。2h后,向细胞中加入BFA。BFA干扰蛋白质从高尔基体到内质网的逆向运输,导致蛋白质在内质网中积累。这意味着在ICS中,细胞因子会在刺激的T细胞中富集。继续刺激额外3-24h后,用荧光标记的抗体对T细胞进行表面标志物染色。随后,细胞被固定、透化,并用荧光标记的抗体染色,针对胞内累积的细胞因子如IFNγ、TNFα或IL-2进行染色。染色后,可以通过流式细胞术分析T细胞的表面标志物和细胞因子染色情况。为了确定T细胞群体的功能亲和力,用于刺激的肽浓度会进行梯度稀释,然后将产生细胞因子的细胞百分比与肽浓度相对应地显示出来。为了获得可比较的参数,计算出能够刺激50%反应性T细胞所需的肽浓度,定义为IC50。
2)铬51释放试验
另一种广泛应用的方法是51Cr释放试验,用于测定功能亲和力。该试验通过检测抗原特异性裂解肽脉冲靶细胞来测量T细胞的直接效应功能。靶细胞被标记上发射γ射线的同位素51Cr并加载肽段。T细胞和靶细胞以特定的效应细胞:靶细胞(E : T)比例共同孵育4-5h,这会导致靶细胞裂解并释放51Cr到上清液中。释放的51Cr量可以通过γ计数器量化,并与裂解的靶细胞数量成正比。因此,可以分析靶细胞杀伤效率以及T细胞群体的效应功能程度。通过梯度稀释加载靶细胞的肽段量,可以类似地计算T细胞群体的功能亲和力,如同ICS方法所述。51Cr释放的程度绘制成"最大裂解百分比"与加载靶细胞的肽浓度的关系图,并计算出50%特异性裂解(EC50)作为可比较参数。
所描述的方法用于确定T细胞的功能亲和力的一个主要优点是它们易于标准化,并可在不同实验室之间转移。因此,所获得的结果具有良好的全球可比性。然而,不可能测量单个细胞的功能亲和力,因为需要整个细胞群体来进行所述的肽滴定实验。此外,由于T细胞的功能亲和力受许多因素影响,并且可能因培养条件而改变,测量T细胞内固有的参数可能会更有趣。
结构亲和力测定
T细胞的结构亲和力取决于TCR、pMHC与共受体CD8或CD4之间的结合强度。这些成分通过静电作用力、氢键、范德华力和疏水相互作用进行交互,即这些物理参数在蛋白质的结构中是固有的,因此是不变的。T细胞转移实验表明,T细胞功能的重要部分在其TCR结构中是固有的。然而,精确测量活T细胞上的这些物理参数具有挑战性。使用不同方法尝试获取有关T细胞结构亲和力的信息。
1)Biacore检测
为了研究TCR和pMHC之间的生物分子相互作用,Biacore系统已被广泛应用。该系统基于表面等离子体共振(SPR)原理,能够表征不同性质样本(如蛋白质、核酸、脂质体、细菌等)的结合事件。通过Biacore系统,可以分析蛋白质相互作用的特异性、强度、结合速率常数(kon)和解离速率常数(koff)。Biacore光学生物传感器由三个核心组件构成:一个光学检测系统,用于监测SPR信号的变化;一个传感器芯片,可以涂覆其中一种相互作用分子;以及一个微流控系统,用于控制缓冲液和样本在传感器芯片上的流动。为了理解这种方法的基本原理,以下将解释SPR的原理。SPR是一种光学现象,通常发生在两种具有不同折射率的介质界面处的薄导电层中。对于Biacore系统,传感器芯片上的薄金层位于芯片的玻璃表面和通过微流控系统流动的样品溶液之间。偏振光穿过芯片的玻璃表面时,在与样品溶液的界面上发生全反射,因为这种介质的光学密度比玻璃表面低。反射光的强度由二极管阵列检测器监测。然而,光的电磁分量--即倏逝波,可以穿透金层进入样品/缓冲溶液。在特定角度下,倏逝波能够激发金层中的电子,形成电子密度波,即所谓的表面等离子体。同时,该角度(SPR角)的光强度降低。相互作用伙伴与固定在传感器芯片表面的样品之间的结合会改变表面质量,从而导致反射光的SPR角发生偏移。这些变化以共振单位(RU)进行测量,1 RU相当于SPR角0.0001°的偏移。1000 RU对应于约1 ng/mm²的平均蛋白质表面浓度变化,这意味着该方法非常灵敏,可以分析弱的巨分子相互作用。金层上覆盖有一层水凝胶基质,其中一个相互作用成分通过共价键固定在基质上,而另一个成分则以溶液形式通过芯片。由于SPR角的变化是实时监测的,因此可以直观地显示相互作用的结合、持续时间和解离(图1.6)。

图1.6 MHC I类肽复合物与TCR偶联的生物传感器表面的结合:(a) TCR共价偶联到表面后与其相应的MHC-肽复合物相互作用的示意图。(b) 使用sH-2Ld与或不与p2Ca肽结合到固定在表面的2C TCR上的典型SPR结合曲线。
由于其对低亲和力事件的高灵敏度,Biacore常用于分析纯化TCR与其pMHC配体之间的相互作用。Corr等人首次使用SPR分析了2C TCR与H2Ld肽复合物之间的特异性、动力学和亲和力。在这些实验中,TCR通过共价键结合到生物传感器表面,证明了TCR结构的完整性和特异性得以保持。在测试的不同H2Ld肽复合物中,2C TCR仅与来自2-氧戊二酸脱氢酶的p2Ca肽结合的H2Ld复合物发生结合。解离动力学研究表明,TCR-pMHC复合物的koff率为0.026s−1,相当于半衰期约为27秒,Kd约为10−7M。另一项研究分析了2C TCR与其不同配体H2-Kb/dEV8、H-2Kbm3/dEV8、H2-Kb/SIYR和H-2Ld/p2Ca的结合,发现同系(H2-Kb)和异系(H-2Kbm3、H-2Ld)配体的亲和力范围为Kd=10−4到10−6。为了将T细胞的免疫活性与其TCR对相应pMHC复合物的亲和力相关联,研究人员对基于p2Ca序列的一系列合成肽进行了单氨基酸突变,并分析了这些突变肽与H-2Ld的结合稳定性、诱导表达H-2Ld和相应肽变体的靶标细胞裂解以及与纯化的可溶性2C TCR的结合情况。尽管对于大多数肽,可以清楚地发现其使2C T细胞致敏进行细胞裂解的能力与2C TCR对相应H-2Ld肽复合物的亲和力之间存在明显相关性,但有一个p2Ca肽变体(L4)能够诱导裂解却未能在SPR分析中与TCR结合。这些数据表明,TCR亲和力并不是激活T细胞的唯一关键参数。其他SPR研究,如检查TCR的激动剂和拮抗剂配体,显示激动剂配体具有更高的亲和力,因此解离速度更慢。此外,通过SPR分析正选择和负选择配体还发现了胸腺中正选择的亲和力窗口。
SPR技术在Biacore分析中的应用提供了一种非常敏感的方法来测定TCR亲和力并产生了重要的发现,但也存在严重的缺点。对于每次SPR亲和力测量,不仅需要重组表达MHC分子,还需要重组表达TCR,而后者在技术上具有挑战性。为了生成可溶性TCR,已经开发了多种方法,包括用糖脂连接的信号序列替换跨膜区域、删除跨膜区域或进行半胱氨酸突变并在大肠杆菌中表达。然而,没有一种方法适用于所有TCR,这使得TCR生产成为一个耗时且困难的过程。此外,研究表明,特别是对于快速反应,可溶性结合伴侣扩散到水凝胶基质中可能会显著降低其整体运输速度,从而在结合过程中引入许多未知因素。最后,SPR设置中的大分子相互作用与生理条件相差甚远。在分析TCR亲和力时,TCR和pMHC复合物都需要通过重组表达,并且一个结合伴侣固定在表面,另一个则处于溶液中。与细胞间相互作用不同,在细胞膜内两个结合伴侣可以在二维空间内移动,而在SPR设置中,只有一个结合伴侣可以移动,但这是在三维空间内。这些差异被认为会影响结合动力学。此外,SPR测量未考虑CD8共受体的作用,而研究表明CD8共受体能够稳定TCR-pMHC复合物。
2)基于多聚体的亲和力测定
基于多聚体技术的结构亲和力测定法可以测量活T细胞表面的TCR-pMHC相互作用。在MHC多聚体技术的初期,研究表明,pMHC分子的四聚体复合物,即MHC四聚体,能够稳定地结合到表面表达其特异性TCR的T细胞上。过去使用了两种不同类型的基于四聚体的亲和力测定法。通过第一种测定法,多个研究小组揭示了四聚体染色强度与T细胞亲和力之间的相关性。由于这种方法的数据生成和分析并不复杂且易于标准化,因此该测定法似乎适合产生可比的T细胞亲和力数据。然而,其他研究发现四聚体染色强度与T细胞亲和力之间缺乏相关性,这表明染色强度还依赖于其他参数,因此不适合提供可靠的T细胞亲和力信息。
在另一种基于四聚体的方法中,四聚体解离动力学被用于量化T细胞亲和力。然而,上述研究中实验的执行方式存在显著差异,特别是在阻断试剂这一变量上。因此,是否使用阻断试剂以及使用的阻断试剂的性质在各研究之间有所不同。所使用的变体包括:不使用阻断试剂、完整的抗MHC抗体、未标记的四聚体和Fab片段。由于需要使用阻断试剂以防止解离后的四聚体重结合,研究了不同阻断试剂对解离动力学的影响。使用MHC抗体作为阻断试剂会使动力学数据的解释复杂化,因为双价抗体能够以不同方式与四聚体染色的细胞相互作用,例如通过将两个四聚体交联在一起或通过将四聚体与标记的T细胞表面表达的MHC I分子连接。事实上,发现使用Fab片段作为阻断试剂时,四聚体解离速度更快,而不用阻断试剂时则无法观察到显著的解离现象。进一步分析了阻断试剂浓度对四聚体解离速率的影响。发现超过某一阈值后,解离速率不再依赖于阻断Fab片段的浓度。然而,阻断MHC抗体的浓度变化会影响解离速率,并且只有在非常高浓度下才会达到饱和。因此,该研究推荐Fab片段作为四聚体解离试验中的合适阻断试剂(图1.7)。除了选择合适的阻断试剂问题外,还需注意基于四聚体的T细胞亲和力测定法不允许分析单体TCR pMHC相互作用。数据的解读基于四聚体结合差异与不同的TCR亲和力相关的假设。然而,由于MHC四聚体的多聚性质,结合水平和解离速率可能受到额外因素的影响,例如膜中TCR的组织结构。此外,多聚化程度,即一个多聚体中的实际MHC分子数量难以控制,但会影响多聚体的解离动力学。因此,多聚体解离测定非常难以标准化。

图1.7 使用阻断抗体的Fab片段作为竞争者的四聚体解离测定模型:MHC I四聚体与T细胞表面的TCR结合(左图)。一个MHC分子的解离及其通过竞争者Fab片段阻止再结合(中图)。在Fab竞争者存在的情况下,所有参与的MHC分子解离并被阻止再结合后,四聚体完全解离(右图)。
总之,即使有几项研究揭示了MHC解离与T细胞亲和力之间的相关性,四聚体的多聚性质干扰了对TCR与pMHC相互作用的正确考察。四聚体的解离首先需要所有MHC分子脱离。然而,由于它们与T细胞表面的距离非常接近,因此局部浓度较高,新脱离的MHC分子可能会重新结合到TCR上,从而形成复杂的高阶动力学。一些报告认为MHC四聚体解离遵循一级解离动力学,但其他报告则描述了更为复杂高阶动力学,尤其是在使用阻断试剂时。
Biacore实验虽然可以在相当人工化的环境中正确计算单体TCR与pMHC的亲和力,但基于MHC四聚体的亲和力实验则测量的是从活T细胞表面解离的动力学,却无法准确测定单个pMHC分子与TCR之间的结合强度。因此,一个改进的实验系统应理想地测量单体pMHC与TCR在活T细胞表面的相互作用。
3)小鼠T细胞的koff速率测定
为了满足改进T细胞亲和力检测的需求,设计了一种新型的koff速率检测方法,并建立了用于测量小鼠T细胞的方法。由于针对小鼠和人类T细胞的koff速率检测基于相同原理,其中针对人类T细胞的检测方法在此基础上可同样建立。koff速率检测基于可逆多聚体,即所谓的Streptamers,可以准确测定单体pMHC从小鼠T细胞上的TCR解离的动力学过程,且该解离动力学与多聚化水平或阻断试剂的性质无关。分析了两条针对李斯特菌单核细胞增生李斯特菌表位 LLO 91-99 的小鼠T细胞系。这些T细胞系用不同浓度的肽段重新刺激,因此表现出不同的功能亲和力(图1.8 a,b)。在实验中,显示了koff速率与T细胞克隆的功能亲和力之间的直接相关性(图1.8 c)。尤为重要的是,当这些T细胞系被转移到随后感染李斯特菌的小鼠体内时,只有具有低koff速率的T细胞系能够保护小鼠免受细菌负荷的影响(图1.8 d)。这种具有低koff速率的T细胞的优越保护能力表明,结构亲和力高的T细胞在过继T细胞治疗中将更为优越。

图1.8 长半衰期与L.m.感染中T细胞系的高功能亲和力和保护性相关:从L.m.感染的Balb/c小鼠中分离出的LLO 91-99特异性CD8+ T细胞,通过分别用10-6M肽(细胞系A,黑圈)和10-9M肽(细胞系B,灰圈)重新刺激生成了LLO 91-99特异性T细胞系。
(a) 使用 (a) ICS 和 (b) 51Cr释放实验分析T细胞系的功能亲和力。
(c) 对两个T细胞系A和B进行koff速率测定。数字表示所有测量细胞的平均t1/2。
(d) 将5*10^6个T细胞系细胞静脉注射到Balb/c小鼠体内,并在1h后静脉注射2*10^4 CFU L.m.感染小鼠。3天后,处死小鼠并分析脾脏中的细菌负荷。
E. Corse, et al. Strength of tcr-peptide/mhc interactions and in vivo t cell responses. J Immunol, 186(9):50395045, May 2011.
L. Cederbom, et al. Cd4+cd25+ regulatory t cells downregulate co-stimulatory molecules on antigen-presenting cells. Eur J Immunol, 30(6):15381543, Jun 2000.
M. A. Derby, et al. High avidity ctl exploit two complementary mechanisms to provide better protection against viral infection than low-avidity ctl. The Journal of Immunology, 166 (3):16901697, 2001.
M. Corr, et al. T cell receptor mhc class I peptide interactions: affinity, kinetics, and specificity. Science, 265 (5174):946949, Aug 1994.
X. L. Wang, et al. Caveats in the design of mhc class I tetramer/antigen-specific t lymphocytes dissociation assays. Journal of Immunological Methods, 280(1-2):25-35, 2003.
不感兴趣
看过了
取消

人点赞

人收藏

打赏
不感兴趣
看过了
取消

打赏金额
认可我就打赏我~
1元 5元 10元 20元 50元 其它
打赏作者
认可我就打赏我~
扫描二维码
立即打赏给Ta吧!
温馨提示:仅支持微信支付!
已收到您的咨询诉求 我们会尽快联系您
