
重点介绍新出现的临床数据,这些数据确立了基于TCR的治疗方法的抗肿瘤潜力
重点介绍新出现的临床数据,这些数据确立了基于TCR的治疗方法的抗肿瘤潜力,用于治疗各种人类恶性肿瘤。
TILs
由于TIL经常富含肿瘤反应性TCR克隆型,它们可以作为非受体工程化ACT的治疗性T细胞来源。TIL疗法是通过手术切除转移性肿瘤,然后体外T细胞扩增来达到治疗数量(10^11个细胞)。T细胞可以大量扩增,也可以根据肿瘤的反应性进行选择。通常在化疗预处理后施用TIL,以耗尽作为稳态细胞因子(如IL-15)的“接收器”的旁观者淋巴细胞,并重塑免疫抑制肿瘤微环境。TIL输注后通常伴随着一种常见的γ链细胞因子IL-2的多天疗程,以促进T细胞植入。黑色素瘤和膀胱癌、乳腺癌、宫颈癌、胃肠道、头颈部、肾、肺、和卵巢,含有对肿瘤抗原具有HLA依赖反应性的TIL。对于这些癌症中的许多,TIL ACT在早期临床试验、能够登记的单臂II期试验和随机III期试验中导致了客观的肿瘤消退。这些发现确立了基于TCR的疗法可以在广泛的人类恶性肿瘤中调解癌症消退的原则证据。
TIL的最大临床经验来自转移性皮肤黑色素瘤患者。在未接受抗PD1/PDL1免疫检查点抑制剂(ICIs)治疗的患者中,ORR和CR都相对较高【ORR:40-62%;CR:7-24%】。重要的是,对TIL治疗CR的患者中,约96%没有复发。黑色素瘤对TIL的反应可能发生在其他治疗方法的进展之后,包括ICIs。然而,尽管先前的抗CTLA4似乎不会影响TIL的效力,但随着针对PD1/PDL1的抗体的进展,应答率往往较低。这表明TIL和抗PD1/PDL1治疗有部分重叠的反应和耐药机制。
与这假设一致,对1000多名接受ICIs治疗的患者进行的聚类分析证实,肿瘤突变负担与ICI反应的可能性之间存在显著关联。同时,TIL研究也同样发现了应答率与肿瘤突变负担或应答率与输液产品中新抗原反应性T细胞的频率之间的相关性。这些数据表明,TIL和ICI治疗的成功可能依赖于新抗原反应性T细胞的丰度。因此,下一代TIL方法,其中新抗原反应性T细胞被选择性地扩增和/或富集,可能允许更一致的肿瘤控制。
除皮肤黑色素瘤外,TIL疗法对葡萄膜黑色素瘤和几种常见的上皮性恶性肿瘤具有临床活性。与皮肤黑色素瘤不同,葡萄膜黑色素瘤是适度突变的,对ICIs大多耐药。在一项II期临床试验中,20名患者中有7名患者接受葡萄膜黑色素瘤TIL治疗后癌症消退,包括1名CR【ORR:35%;CR:5%】。在有反应的患者中,有3人以前在ICIs上有进展。在一项特殊分析中,有反应的患者与无反应的患者相比,接受了显著更多的肿瘤反应性T细胞。在第二项研究中,16名NSCLC患者在肿瘤进展后接受了抗PD1抗体的TIL治疗,其中3名患者有癌症复发,包括2例持续的1.5年后的CR【ORR:19%;CR:13%】。在这项研究中,应答者比无应答者更有可能接受含有新抗原的TIL和癌症生殖系反应性T细胞。在第三项试验中也观察到了类似的结果,该试验测试了TIL疗法对HPV相关癌症的治疗,在接受TIL治疗的18例HPV阳性宫颈癌患者中,有5例患者OR,其中2例持续4年后的CR【ORR:28%;CR:11%】。免疫监测研究显示,2名CR的患者的输注产品中含有针对新抗原、CGAs和HPV E6/E7癌蛋白的多肽。在一组HPV阳性的口咽癌、肛门癌和阴道癌患者中,11名受试者中有2名PR【ORR:18%;CR:0%】。在这两组中,输注产品中HPV E6/E7反应性T细胞的频率以及外周血中肿瘤反应性T细胞的持久性与应答的可能性相关。
最后,病例报告记录了适度突变的上皮性恶性肿瘤对TIL ACT的反应。例如,在两名与DNA错配修复能力相关的胃肠道恶性肿瘤患者中,新抗原选择的TIL的ACT导致肿瘤消退。1例侵袭性胆道癌患者,在输注识别患者特异性新抗原的接近克隆性的CD4+TIL群体后,有较长的客观PR。值得注意的是,这位患者在接受新抗原选择的T细胞超过10倍的剂量之前,对未选择的TIL群体没有反应。另1名转移性结直肠癌(CRC)患者在输注新抗原选择的CD8+T细胞后也有PR。在这种情况下,约75%的被转移的T细胞识别来自KRAS G12D热点突变的共享或公共新肽。在这位患者中,除一处肺部病变外,所有转移灶都消退了。对这一逃逸损伤的分析揭示了呈现KRAS G12D衍生肽的HLA的杂合性丢失(LOH),建立了一种靶向免疫逃逸的机制。这项研究中的另一位患者接受了对相同的KRAS G12D公共肿瘤抗原反应性的TIL,但没有反应。在这种情况下,只有0.002%的输注产品是新肽专一性的。最后,3名转移性乳腺癌患者在接受新抗原选择的TIL治疗后,肿瘤客观消退。在1名获得持久CR的患者中,输注产品中约23%的T细胞针对由四个受HLA I和HLA II限制的体细胞突变基因产生的新表位。另2例PR分别持续6个月和10个月。总而言之,这些例子提供了进一步的证据,即新抗原反应性T细胞的输注可以在人体内引发肿瘤消退。
T细胞克隆
尽管TIL相对富含肿瘤反应性T细胞,但它们通常含有大量无助于抗肿瘤免疫的旁观者T细胞。富集同质细胞产品的一种策略是扩增单一的、明确特异性的T细胞克隆进行治疗。T细胞克隆已经从TIL和癌症患者的循环谱系中产生,使用单独IVS、或IVS后p/HLA分选、或IVS后有限稀释克隆。最初的临床经验是T细胞克隆的ACT主要针对非突变的组织分化抗原(TDAs)。大多数早期的T细胞克隆临床试验针对的是来自共同的黑素细胞/黑色素瘤分化抗原的表位:MART-1、gp100和酪氨酸酶。总体而言,在这些研究中,患者经历了有限的与治疗相关的毒性,大多数副作用可归因于预期的on-target/off-tumor对正常黑素细胞的破坏。然而,临床活动总体上是适度的(ORR<10%)。
另一个重要的抗原类别是CGAs,这是一个由100多种免疫原性细胞内蛋白组成的家族,其正常组织表达通常(尽管不是普遍)仅限于生殖细胞和胎儿组织。由于生殖细胞缺乏HLA的表达,它们具有免疫特权,不受T细胞介导的攻击。因此,与TDA相比,靶向CGA可提供更广泛的治疗指标。许多CGA通过启动子甲基化在体细胞组织中表观遗传沉默。肿瘤发生过程中表观遗传失调可导致CGA基因座表达下调,从而导致肿瘤选择性靶点的表达。在一项案例研究中,1名接受了针对CGA NY-ESO-1的HLA II限制性CD4+T细胞克隆的难治性转移性黑色素瘤患者经历了长期和完全的肿瘤消退。与使用TIL的研究结果类似,转移的T细胞克隆在体内的持久性与临床应答的可能性之间存在相关性。在大多数试验中观察到的T细胞克隆的有限临床疗效可能是由于延长的克隆制造过程导致细胞分化增强和体内持久性差。在T细胞启动期间通过改变细胞因子来增强细胞适合性的策略,选择具有类似记忆属性的克隆,以及在扩增期间优化共刺激可能会改善结果。
TCR-T细胞
TCR基因转移简化了与TIL和T细胞克隆治疗相关的许多实际挑战。这些益处包括:获得自体T细胞的微创程序(如白细胞分离);在相对较短的时间内开发出强大细胞产品的可能性很高;有机会预先选择具有最佳效力和非靶标特征的TCR;能够将TCR引入具有优越植入和增殖潜力的分化最低的T细胞群中;以及有机会同时引入通过增强T细胞存活率、抵抗抑制配体或通过TCR复合体增强抗原驱动的信号来增强T细胞功能的基因操作。TCR临床试验针对不同类别的抗原,在许多情况下,针对来自同一抗原的不同表位(表1)。
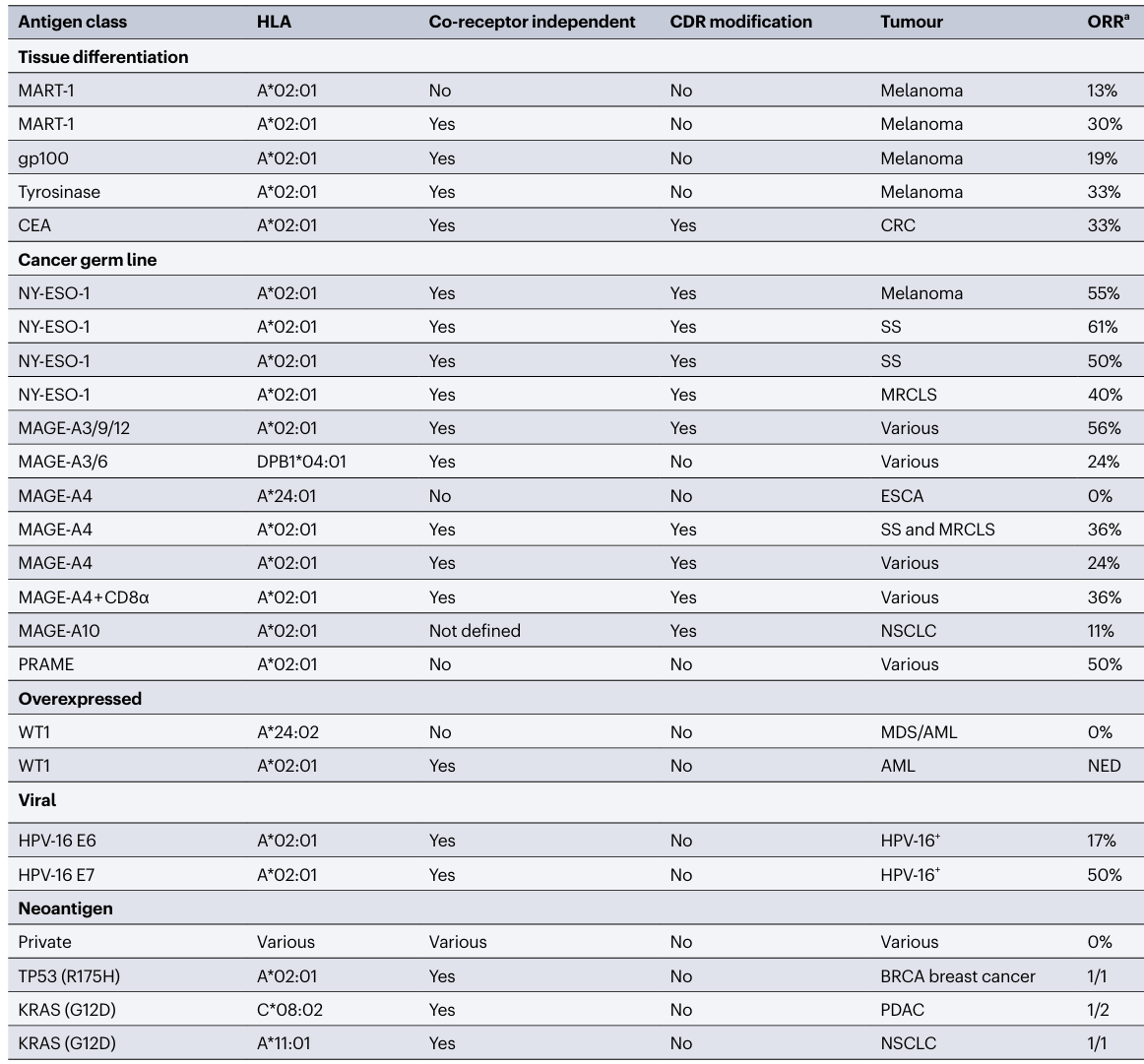
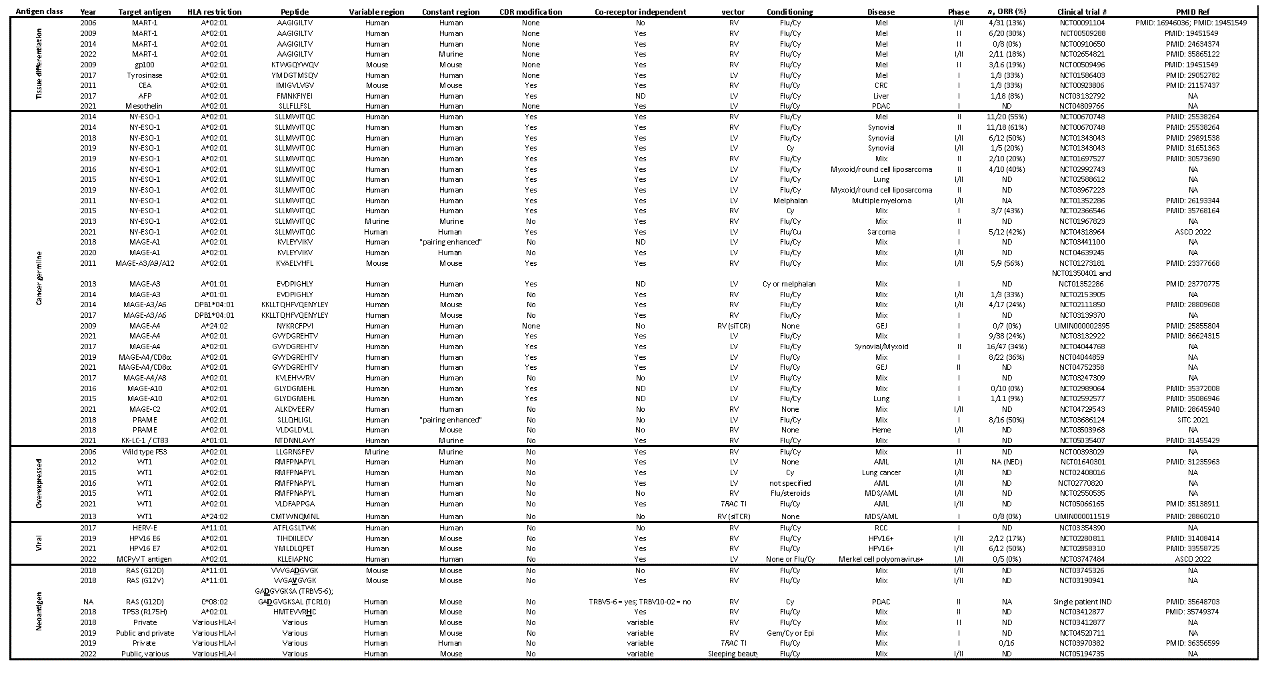
表1 部分TCR治疗临床试验
组织分化抗原(TDA)
与使用T细胞克隆的研究一样,最初的TCR治疗研究针对的是未突变的组织分化抗原。首次发表的人类TCR临床试验测试了从黑色素瘤TIL克隆并转导入同种异体T细胞系的MART-1多肽的HLA-A*02:01限制性受体。前两个使用自体T细胞的TCR临床试验顺序测试了一对针对同一MART-1肽的受体(DMF4和DMF5),但这些受体是从另一名患者的TIL中克隆出来的。在第一项自体试验中,31名黑色素瘤患者接受了逆转录病毒转导的依赖于CD8共受体的DMF4 TCR的T细胞,其中4名患者获得PR【ORR:13%】。没有患者出现与TCR修饰细胞相关的毒性。在第二项试验中,患者接受了用DMF5受体修饰的T细胞,DMF5受体是一种CD8共受体非依赖的TCR,亲和力是DMF4的5倍。在接受DMF5 TCR的20名患者中,6名患者有客观的肿瘤反应【ORR:30%】。然而,相当大比例的on-target毒性与破坏皮肤、眼睛和内耳中存在的表达MART-1的黑素细胞有关。在第三项试验中观察到了抗肿瘤活性和on-target毒性,该试验针对来自黑素细胞相关蛋白gp100的HLA-A*02:01限制性表位的CD8共受体非依赖性TCR。与DMF4和DMF5不同,该受体是在HLA-A*02:01 Tg小鼠中产生的。在接受治疗的16例患者中,3例有效【ORR:19%;CR:6%】。在这项研究中也观察到了与黑素细胞靶向相关的显著on-target毒性。在第四项试验中,靶向组织不同抗原的可能性在黑色素瘤的背景下被建立,该试验针对的是来自胃肠道谱系标记物癌胚抗原(CEA)的多肽。3名CRC患者接受了在HLA Tg小鼠中亲和力增强的TCR基因工程的T细胞。在T细胞输注后,所有患者的血清CEA显著降低,表明达到了目标,1名患者有PR【ORR:33%】。然而,由于T细胞介导的CEA+结肠上皮细胞的破坏,所有患者都出现了严重的炎症性结肠炎。总而言之,这些早期临床试验确立了TCR治疗可以引发癌症消退,同时也强调了靶点选择和受体亲和力的关键重要性。
过表达的、未突变的抗原
非突变表位来源于转录调节因子,包括WT1和P53,通常在血液病和实体瘤中过度表达。虽然不是癌症特异性的,但这些蛋白的表达在正常组织和转化组织之间的差异可能高达1000倍,提供了一个潜在的治疗窗口。几个HLA I限制的WT1表位已经被从健康donor克隆的TCR作为靶点,没有证据表明正常组织毒性。在一项在白血病患者中测试依赖CD8共受体的TCR研究中,没有观察到客观的抗肿瘤反应。两个CD8共受体非依赖的WT1 TCR已经进入血液瘤和实体瘤的治疗试验。在一项研究中,受体被整合到TRAC基因座上,然后使用CRISPR编辑破坏TRBC1/2基因座(NCT05066165),这些研究的疗效结果即将公布。在早期临床试验中,针对HLA Tg鼠中产生的野生型P53表位的CD8共受体非依赖性TCR进行了测试。尽管转导了这种TCR的同种异体T细胞在体外表现出对多种癌症的反应性,但表达这种受体的自体T细胞不能有效地扩增。这一发现与激活的T细胞和TCR依赖性细胞因子增加野生型P53的表达有关。这些数据表明,与癌细胞相比,正常细胞野生型P53表达的差异可能不足以允许安全的免疫靶向。
癌症胚系抗原(CGA)
第一个CGA TCR试验针对的是来自NY-ESO-1的HLA-A*02:01限制性表位,该表位使用从黑色素瘤患者克隆的亲和力增强的CD8共受体非依赖性受体。一项针对黑色素瘤患者中的初步试验报告ORR>50%【ORR:55%;CR:20%】,没有off-tumor毒性。这一应答率与在接受TILs治疗的同期黑色素瘤患者组中观察到的应答率相当,表明单一表位靶向可能与靶向多个抗原的方法相当。在滑膜细胞肉瘤(SS)和粘液/圆形细胞脂肪肉瘤(MRCLS)中也观察到使用这种TCR的抗肿瘤效果【ORR:40-61%;CR:0-8%】,这两种间叶性癌症对其他免疫疗法反应不佳。
MAGE-A家族的CGA由12个基因组成,其中几个基因已经成为TCR试验的靶点。前两个MAGE TCR试验使用HLA I限制性受体靶向A3亚型。一项试验使用了一种亲和力增强的CD8共受体非依赖的TCR,该TCR产生于HLA-A*02:01 Tg鼠,9名患者中有5名客观缓解【ORR:56%;CR:11%】作为剂量递增研究的一部分。然而,接受最高T细胞剂量的5名患者中有3名出现了严重的神经毒性,导致2名与治疗相关的死亡。这些毒性是由于先前未被认识的表达MAGE-A12的神经细胞群在off-tumor被破坏所致,MAGE-A12是一种与MAGE-A3同源性>95%的蛋白质。同时,针对MAGE-A3的第二个试验报告了使用受HLA-A*01:01限制的亲和力增强的TCR的致命毒性。这项研究中的2名患者在T细胞输注后出现心源性休克,这是由于off-tumor/off-target识别来自肌联蛋白的表位。在这种情况下,亲和力增强改变了的天然受体的特异性,这种改变最初在使用表达限制性HLA的多种正常细胞的临床前研究中没有检测到。第三项试验也针对MAGE-A3表位,与其他研究不同的是,本试验中使用的患者来源的TCR受到HLA II的限制,并且没有进行亲和力增强。作为生产过程的一部分,分离CD4+T细胞,以在生理环境下测试HLA II限制性TCR的安全性和抗肿瘤效果。在接受治疗的17例患者中,没有发生off-tumor毒性,4例患者有客观的肿瘤反应【ORR:24%;CR:6%】。有趣的是,许多患者在治疗后经历了长期的发烧,这一发现可能是由于CD4+T细胞分泌的细胞因子增加。
MAGE-A4和MAGE-A10也都是TCR治疗试验的靶点。一项针对MAGE-A4的初步试验未能显示出抗肿瘤活性,该试验使用的是一种HLA-A*24:02限制性、CD8共受体依赖、非亲和力增强的受体。相反,针对这种CGA的亲和力增强的TCR在软组织肉瘤中显示出有效性,但在其他实体肿瘤中活性有限。共表达CD8α和TCR的多顺反子载体似乎改善了常见上皮性恶性肿瘤的反应【ORR:36%;CR:5%】(注:更多细节可阅读《Afami-cel和ADP-A2M4CD8两款靶向MAGE-A4 TCR-T治疗实体瘤的临床数据》和《HLA-A*02+患者MAGE-A4+实体瘤的自体T细胞治疗》),包括卵巢癌、头颈部癌和胃食道癌。几项试验针对具有亲和力增强的HLA-A*02:01限制性TCR的MAGE-A10,到目前为止,还没有证据表明这种受体具有off-tumor毒性;然而,临床活性的证据很少。
黑色素瘤中优先表达的抗原(PRAME)是一种CGA,在黑色素瘤和非黑色素瘤肿瘤中都经常表达。最近,一项使用针对HLA-A*02:01限制性PRAME表位的天然产生的TCR的剂量递增试验报告了对多种实体肿瘤的反应【ORR:50%;CR:0%】,但没有发现off-target毒性的证据。一种靶向替代HLA-A*02:01限制性PRAME表位的TCR已进入血液病患者的临床研究(NCT03503968)。
病毒癌蛋白
病毒蛋白是免疫外源性的,不在正常组织中表达,在某些情况下,直接导致恶变。因此,它们代表了一个有吸引力的共享癌症特异性表位的来源。几项临床试验已经测试了针对病毒编码的癌蛋白的TCRs的安全性和抗肿瘤活性。
两项针对HPV-16 E6和E7癌蛋白的HLA-A*02:01限制性表位的临床试验强调了TCR亲和力和临床活性之间的关联。在一项I/II期研究中,HPV-16相关癌症患者接受了TCR转导的T细胞,TCR结合来自E6癌蛋白的表位。这项研究中使用的患者来源的TCR以不依赖于CD8共受体的方式发挥作用,并且不包含对其可变区的修饰。在接受治疗的12名患者中,没有出现off-target毒性的证据,2名患者的肿瘤缩小【ORR:17%】。对无反应患者治疗后肿瘤样本的分析发现,1例具有HLA-A*02:01杂合性缺失,另1例具有IFGNR1移码突变,IFGNR1是一种与抗原呈递有关的关键基因。相比之下,在有反应的患者中,没有观察到抗原加工和呈递基因的突变。
第二项研究中,患者接受患者来源TCR转导T细胞,该TCR靶向HPV-16 E7癌蛋白表位。与E6 TCR类似,E7 TCR以CD8共受体非依赖的方式发挥作用,并且含有未改变的可变区。然而,与E6 TCR相比,E7 TCR的Koff速率明显较慢,表明其结构亲和力更高。在接受E7 TCR-T细胞治疗的12名患者中,6名患者PR【ORR:50%】,其中4名患者在先前的抗PD1治疗中取得进展,没有患者出现off-target毒性反应。4名患者的肿瘤在干扰素信号转导、HLA I呈递或HLA-A*02:01表达方面存在功能突变。当与E6 TCR试验的结果一起比较时,这些数据表明免疫编辑经常发生在HPV相关的癌症中。
Merkel细胞癌是一种罕见的侵袭性皮肤癌,约80%的病例是由转化的默克尔细胞多瘤病毒(MCPyV)引起的。来自MCPyV编码的癌蛋白的多个表位驱动患者的T细胞反应,包括HLA-A*02:01限制性表位。针对患者来源的HLA-A*02:01限制性、CD8共受体非依赖的TCR目前正在I/II期临床试验中进行测试。
个性化新抗原
最近的一项临床试验测试了一种高度个性化的细胞治疗方法,使用非病毒CRISPR-Cas9基因组编辑将私有的肿瘤抗原反应的TCRαβ序列引入多克隆T细胞。在这项研究中,每个患者的肿瘤都进行了WES测序和RNA-seq,以确定独特的表达突变情况。然后,选择计算机预测的HLA I新抗原的精选列表,将其整合到定制的p/HLA捕获库中。从循环T细胞中提取与这些p/HLA复合体结合的TCRs的基因序列,并测试这些TCRs的功能以检测其触发抗原特异性细胞因子释放的能力。患者接受了最多3种独特的TCR修饰的自体T细胞。在CRISPR对TRAC/TRBC进行编辑后,通过同源定向修复将外源TCR插入到TRAC基因座中,以去除内源性TCR。免疫监测显示,TCR编辑植入外周血中的细胞,并被贩运到转移的肿瘤部位。接受治疗的16例患者中,5例SD,11例PD。虽然没有观察到客观反应,但这项研究确定了使用完全非病毒TCR基因组编辑方法同时靶向多个新抗原的可行性和安全性。
公共新抗原
两个原理验证的临床试验最近确定了使用TCR疗法靶向由反复突变的驱动基因产生的公共新抗原的治疗潜力。在一项试验中,患者与单独转导的T细胞共输注两个靶向KRAS G12D热点突变产生的9mer或10mer的HLA-C*08:02限制性TCR。这两个TCR都是从一名KRAS G12D结直肠癌患者身上克隆出来的,该患者在接受新抗原选择的TIL治疗后出现客观反应。1名胰腺癌患者在输注TCR-T细胞后获得了持久的PR,持续时间超过6个月,且该细胞产品没有毒副作用。另1名接受TCR-T细胞治疗的胰腺癌患者出现CRS,肿瘤没有消退。在第二个试验中,1名难治性乳腺癌患者接受了由肿瘤抑制基因TP53中的热点突变(R175H)产生的表位HLA-A*02:01限制性TCR转导的T细胞。TCR是从一例转移性CRC患者的TIL中克隆出来的,其功能不依赖于CD8共受体。T细胞输注后,患者立即出现CRS;然而,通过静脉注射类固醇后,这些症状迅速缓解。患者随后达到了客观的PR,持续6个月。对一个新的转移肿瘤部位的基因组测序显示,HLA-A*02:01的杂合性缺失可能是一种耐药机制。
可溶性双特异性TCR和TCR mimic
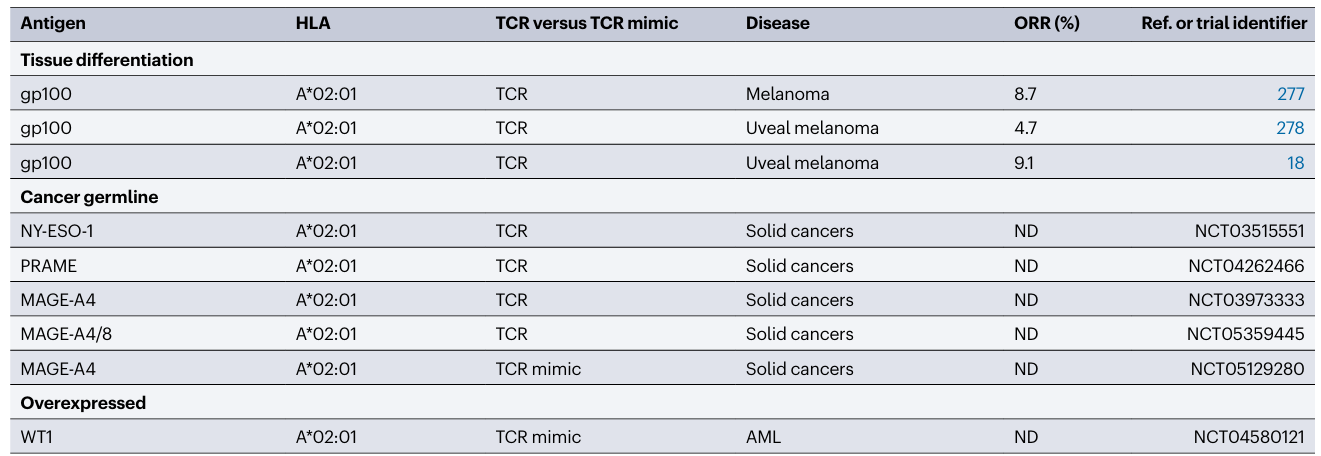
多种ImmTACs和TCR mimic已进入人体临床试验(表2)。Tebentafusp是一种靶向HLA-A*02:01限制性gp100表位的ImmTAC,FDA批准用于治疗无法切除或转移性葡萄膜黑色素瘤的患者。靶向NY-ESO-1、MAGE-A4、MAGE-A8和PRAME的HLA-A*02:01限制性表位的ImmTAC目前正处于早期临床开发阶段。在I-III期试验中,服用Tebentafusp后的总体缓解率不高(4.7-9.1%)。然而,在一项随机的III期试验中,与对照组相比,接受Tebentafusp治疗的患者总体存活率显著提高。事实上,传统的反应标准与总存活率没有很强的相关性,这使人想起其他免疫疗法,并表明Tebentafusp可能改变肿瘤生长动力学。如果放射学反应与生存获益的分离是一种分级效应,则可溶性双特异性TCRs的临床开发可能相对较长和昂贵。与基于T细胞治疗的不同,单臂II期试验的高总体缓解率而在复发/难治环境下获得FDA批准,可溶性双特异性TCR注册试验需要随机设计。总体而言,ImmTACs的毒性似乎与其他双特异性T细胞结合蛋白相似,这包括可逆的和一般轻微的CRS,在最初的几次剂量后缓解。已观察到Tebentafusp具有预期的on-target/off-tumor毒性,如皮疹和白癜风。重要的是,到目前为止,在接受ImmTACs的患者中还没有观察到严重的神经毒性事件。
表2 可溶性双特异性TCR和TCR mimic临床试验
Hong, D. S. et al. Autologous T cell therapy for MAGE-A4+ solid cancers in HLA-A*02+ patients: a phase 1 trial. Nat. Med. 29, 104–114 (2023).
D’Angelo, S. P. et al. Primary efficacy and safety of letetresgene autoleucel (lete-cel; GSK3377794) pilot study in patients with advanced and metastatic myxoid/round cell liposarcoma (MRCLS). J. Clin. Oncol. 40, 11500–11500 (2022).
Hong, D. S. et al. 540P safety and efficacy from the SURPASS trial with ADP-A2M4CD8, a SPEAR T-cell therapy incorporating a CD8α co-receptor and an affinity optimized TCR targeting MAGE-A4. Ann. Oncol. 32, S604–S605 (2021).
Martino, M.D. et al. Translating Science into Survival: Report on the Sixth International Cancer Immunotherapy Conference. Cancer Immunol Res. 11, 145–149 (2023).
Carvajal, R. D. et al. Clinical and molecular response to Tebentafusp in previously treated patients with metastatic uveal melanoma: a phase 2 trial. Nat. Med. 28, 2364–2373 (2022).
Rohaan MW et al. Tumor-Infiltrating Lymphocyte Therapy or Ipilimumab in Advanced Melanoma. N Engl J Med. 387, 2113-2125 (2022).
Wermke, M. et al. Safety and anti-tumor activity of TCR-engineered autologous, PRAME-directed T cells across multiple advanced solid cancers at low doses—clinical update on the ACTengine® IMA203 trial. J. Immunother. Cancer 9, A1009–A1009 (2021).
Klebanoff, C.A. et al. T cell receptor therapeutics: immunological targeting of the intracellular cancer proteome. Nat Rev Drug Discov (2023).
Nathan, P. et al. Overall survival benefit with tebentafusp in metastatic uveal melanoma. N. Engl. J. Med. 385, 1196–1206 (2021).
Levi, S. T. et al. Neoantigen identification and response to adoptive cell transfer in anti PD-1 naive and experienced patients with metastatic melanoma. Clin. Cancer Res. 28, 3042–3052 (2022).
Kim, S. P. et al. Adoptive cellular therapy with autologous tumor-infiltrating lymphocytes and T-cell receptor-engineered T cells targeting common p53 neoantigens in human solid tumors. Cancer Immunol. Res. 10, 932–946 (2022).
Blumenschein, G. R. et al. Phase I clinical trial evaluating the safety and efficacy of ADP-A2M10 SPEAR T cells in patients with MAGE-A10+ advanced non-small cell lung cancer. J. Immunother. Cancer 10, e003581 (2022).
Veatch, J. et al. Merkel polyoma virus specific T-cell receptor transgenic T-cell therapy in PD-1 inhibitor refractory Merkel cell carcinoma. J. Clin. Oncol. 40, 9549 (2022).
不感兴趣
看过了
取消

人点赞

人收藏

打赏
不感兴趣
看过了
取消




您已认证成功,可享专属会员优惠,买1年送3个月!
开通会员,资料、课程、直播、报告等海量内容免费看!

打赏金额
认可我就打赏我~
1元 5元 10元 20元 50元 其它
打赏作者
认可我就打赏我~
扫描二维码
立即打赏给Ta吧!
温馨提示:仅支持微信支付!
已收到您的咨询诉求 我们会尽快联系您
