
在97例最初未接受含利妥昔单抗(rituximab)治疗的FL患者中,VAF≥20%的BCL2非同义突变与进展风险增加相关,并有缩短无事件生存期的趋势。
如何识别疾病负荷低但早期进展风险高的滤泡性淋巴瘤(FL)患者尚不清楚。之前的研究表明,在活化诱导胞嘧啶核苷脱氨酶(AICDA)位点携带高变异丰度(VAF)BCL2突变的FLs可发生早期进展,基于此,研究者在199个新诊断的1级和2级FLs中检测了11个AICDA相关靶基因突变,包括BCL2、BCL6、PAX5、PIM1、RHOH、SOCS和MYC。52%的病例发生了VAF≥20%的BCL2突变。在97例最初未接受含利妥昔单抗(rituximab)治疗的FL患者中,VAF≥20%的BCL2非同义突变与进展风险增加相关(HR 3.01, 95%CI 1.04-8.78,p=0.043),并有缩短无事件生存期的趋势(EFS,有突变的中位时间为20个月,而无突变的中位时间为54个月,p=0.052)。其他测序基因的突变频率较低,并且未增加预后价值。在整个人群中,VAF≥20%的BCL2非同义突变与EFS降低(在FLIPI和治疗校正后,HR 1.55,95%CI 1.02-2.35,p=0.043)以及中位14年随访后总生存率降低(HR 1.82,95%CI 1.05-3.17,p=0.034)相关。因此,即使在化疗免疫治疗时代,高VAF BCL2非同义突变仍具有预后意义。

研究背景
FL是最常见的淋巴肿瘤之一,在美国每年有1~1.5万例新发病例,患病率为14万,这反映了许多患者的疾病惰性。FL的治疗通常采用观察、抗CD20单药治疗(如利妥昔单抗),或者抗CD20联合强化化疗(如环磷酰胺、多柔比星、长春新碱和泼尼松[CHOP]或苯达莫司汀[BR])。然而,即使采用这种化疗免疫疗法,仍有约20%的患者在24个月内不能达到完全缓解或复发。目前尚不清楚如何前瞻性地识别诊断时不良预后风险最高的FLs。
绝大多数FLs携带t(14;18)染色体易位,该易位将BCL2基因和免疫球蛋白重链位点并置。这种易位导致BCL2蛋白表达增强,从而抑制细胞凋亡。此外,BCL2基因还受到AICDA的诱变作用,AICDA是一种集中在免疫球蛋白位点的酶,它参与诱变作用,导致正常生发中心B细胞的抗体多样化。之前有报道称FLs可以维持AICDA的表达,并且携带许多AICDA相关基因突变,包括MYC、PAX5、SOCS1、BCL6、RHOH以及BCL2。采用变异丰度为1%的NGS进行检测,在绝大多数FLs中发现了BCL2突变,在相当一部分病例中发现了其他基因突变。
如何最佳地管理新诊断的、相对无症状的FL仍然是一个讨论的话题,特别是在Covid-19大流行期间。在利妥昔单抗问世之前,小体积病灶的淋巴瘤患者经常被观察到出现疾病负荷增加或FL进展为侵袭性更强的淋巴瘤。早期研究表明,进展率约为3%/年,进展后接受强化化疗的患者中位生存期为2-3年。对FL进展前接受利妥昔单抗治疗的患者进行分析表明,进展率降低。因此,高肿瘤负荷的新诊断FL患者通常接受基于烷化剂或蒽环类药物的化疗免疫治疗。相比之下,小体积病灶的患者接受利妥昔单抗单药治疗或密切观察直到疾病进展需要治疗,这种情况最常发生在前5年。最近的分析继续表明,早期FL的及时治疗并不能带来总生存获益,但仍需要确定哪些患者病情会恶化,哪些患者可能从早期治疗中获益。
考虑到这一点,许多之前的研究试图确定预测早期进展的临床或生物学因素。例如,据报道,一种称为m7-FLIPI的预后指数可识别一线化疗免疫治疗后早期失败风险最高的FL,该指数由一组7个基因和临床特征(FL国际预后指数(FLIPI)的一部分)组成。虽然该预后指数在大体积病灶中表现良好,但在小体积病灶新诊断FL中不能提供预后信息。虽然其他参数(如无事件生存至12或24个月)也具有预后意义,但在一线治疗前确定预后可能比观察治疗后的缓解持续时间更有利。
在之前的一项研究中,研究者利用Sanger测序研究了FL的BCL2突变。评估的检测限为VAF 20%,结果显示(i)一部分FLs携带VAF≥20%的BCL2单核苷酸变异(SNVs),(ii)大多数这些SNVs是改变氨基酸的(非同义),(iii)这些BCL2 SNVs的存在与早期FL进展和早期死于淋巴瘤相关。然而,该研究受到以下事实的限制:所有患者都是在利妥昔单抗问世前诊断的,以确保有足够的随访来评估预后意义。相比之下,随后的两项研究对所有接受含利妥昔单抗治疗的患者进行了研究,未发现BCL2突变对无事件生存期或总生存期产生任何影响,因此利妥昔单抗有可能减轻BCL2突变的任何不良影响。
在本研究中,对2001年以后(即利妥昔单抗成为FL的治疗选择)诊断和治疗的患者使用NGS确定了更广泛的AICDA相关基因突变。本研究的结果不仅继续表明,存在主要BCL2非同义突变(VAF≥20%)与未接受利妥昔单抗治疗的FLs早期进展之间存在关联,而且还表明,在延长随访期间,存在的主要BCL2非同义突变与总生存期(OS)之间存在关联,这种关联可能无法通过早期含利妥昔单抗治疗完全缓解。
研究结果
BCL2和其他AICDA相关靶基因的突变频率:
为了扩展之前对BCL2突变的研究,在新诊断的FL患者中,研究者利用靶向捕获和大规模并行DNA测序来识别AICDA相关靶基因突变(BCL2、BCL6、PIM1、RHOH、PAX5、SOCS和MYC)。研究使用199例确诊为1级或2级FL患者的初始诊断样本,这些患者在2002年至2009年期间被诊断,当时利妥昔单抗可用于治疗FL。这些患者的初始治疗包括观察(43%),利妥昔单抗单药治疗(12%)、R-CHOP或R-CVP的化疗免疫疗法(34%)或一些其他治疗(11%)。患者特征和生存情况见表1。在该队列中,通过FLIPI分层的EFS和OS是FL的典型特征。
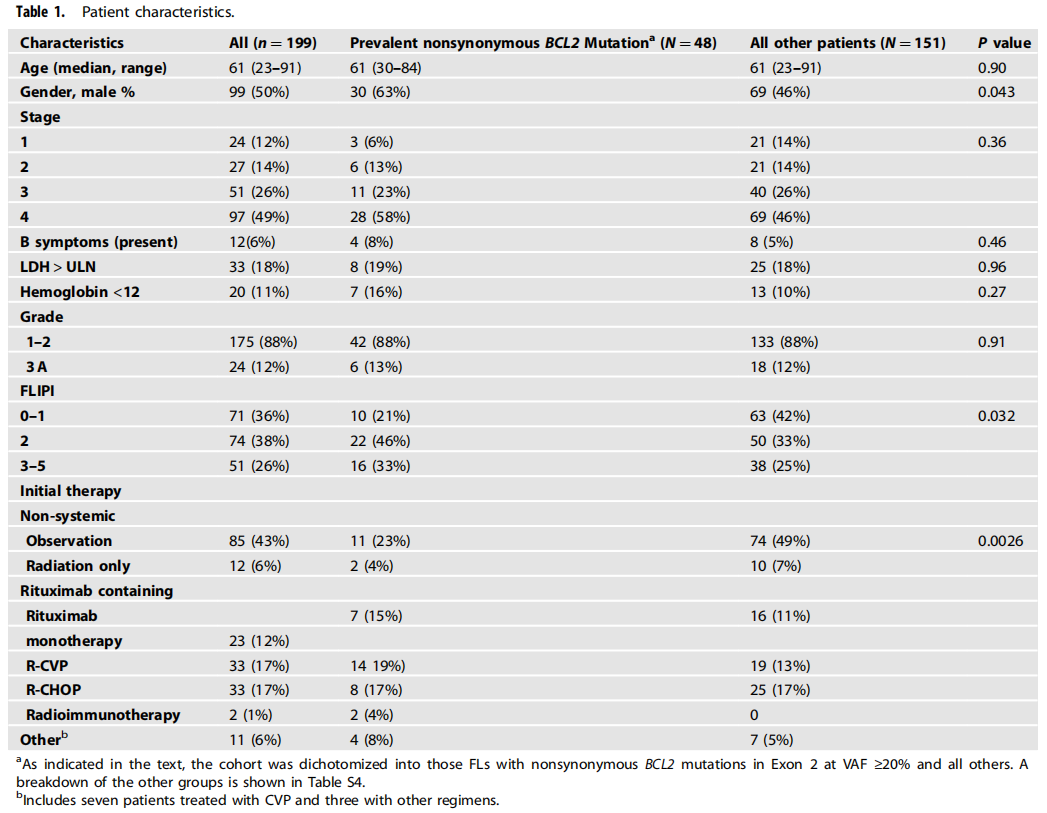
表1
测序结果显示,51.8%的FLs在诊断时携带VAF≥20%的BCL2突变(图1A)。在携带BCL2突变的样本中,平均观察到有2.6个BCL2 SNVs(范围1~12,图1B)。当VAF≥20%作为临界值时,这些突变通常是非同义突变(图1C),并且主要发生于2号外显子(图1D)。当VAF≥5%作为临界值时,观察到类似的情况。BCL2和其他AICDA相关靶基因同时发生突变的频率较低,在103例携带BCL2突变的FLs中,仅有6例携带VAF≥20%的PIM1突变,这一频率过低,无法与有意义的预后关联。
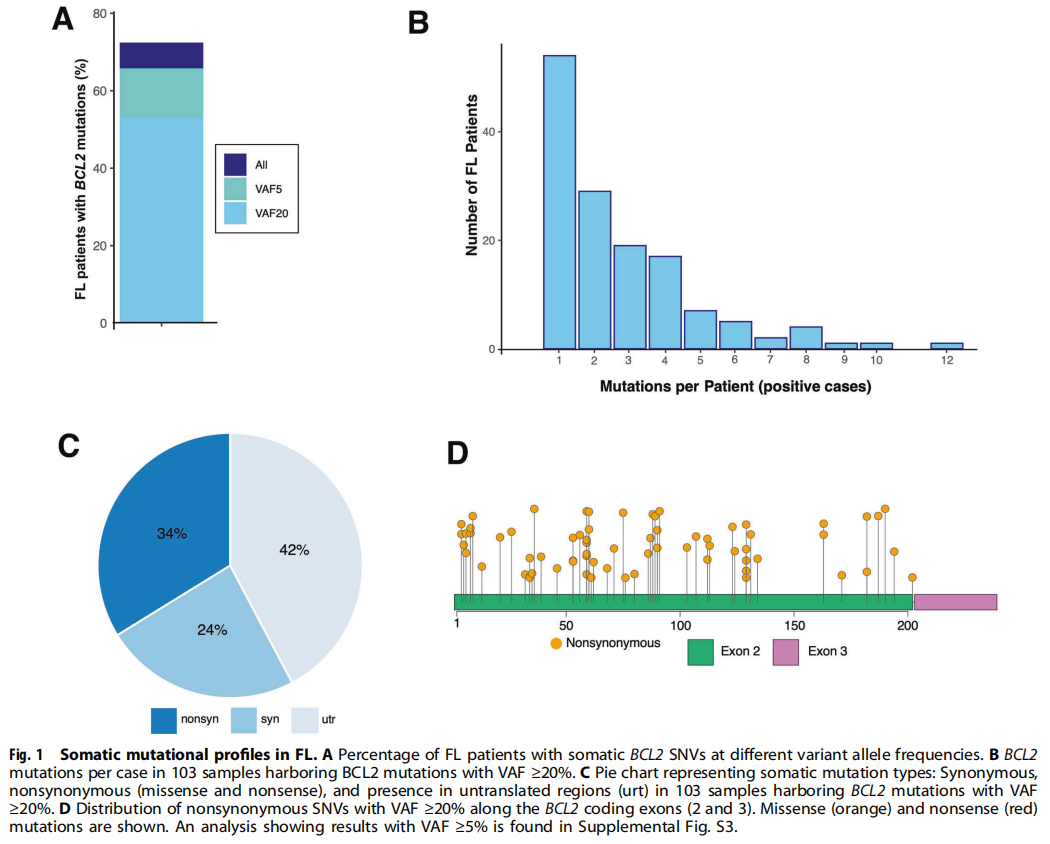
图1
BCL2突变与EFS和OS之间的关联:
在中位166个月随访时,133例患者(67%)发生了事件,31例FLs(16%)发生了进展,56例患者(28%)死亡,其中29例死于淋巴瘤,11例死于其他原因,16例死于不明原因。VAF≥20%(之前研究的检测下限)的BCL2突变与各种预后指标(如EFS、OS、进展风险和淋巴瘤相关死亡风险)之间的关系见表2。
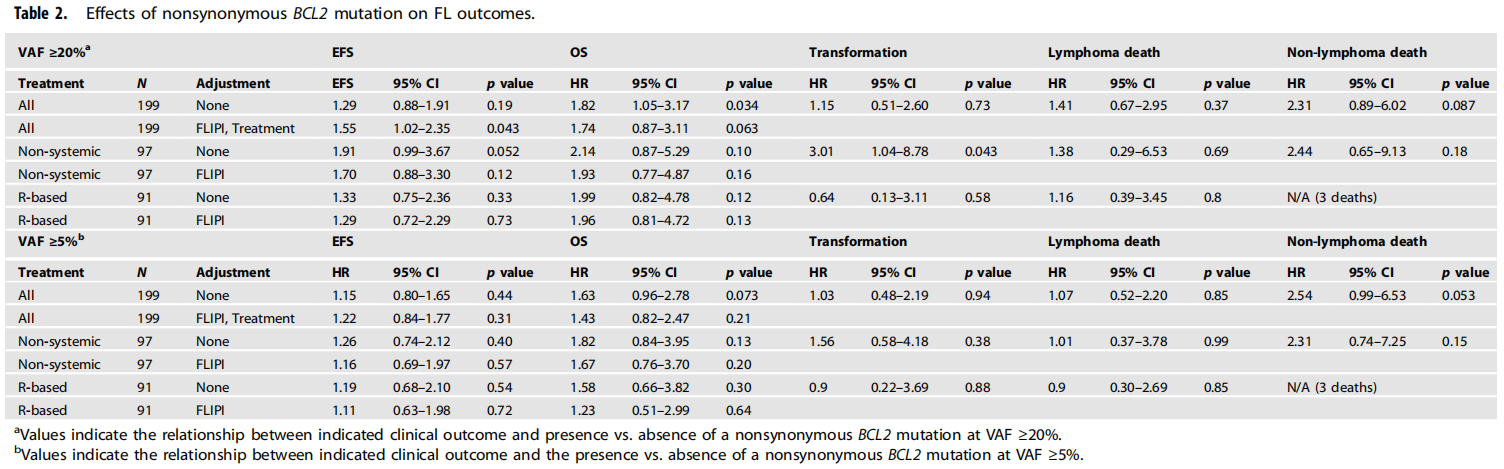
表2
在随后的分析中,该队列被分为携带VAF≥20% BCL2非同义突变的患者(之前的研究中预后不良的患者亚组,为便于参考,研究者将其描述为“主要的BCL2非同义突变”)和其他患者。无论接受何种治疗,携带主要的BCL2非同义突变的患者的中位EFS为50个月,而其余患者的中位EFS为74个月(图2A,p=0.19)。在携带主要的BCL2非同义突变的患者与无该突变的患者中,EFS12为77 vs 86%(p=0.17),EFS24为66 vs 77%(p=0.19)。
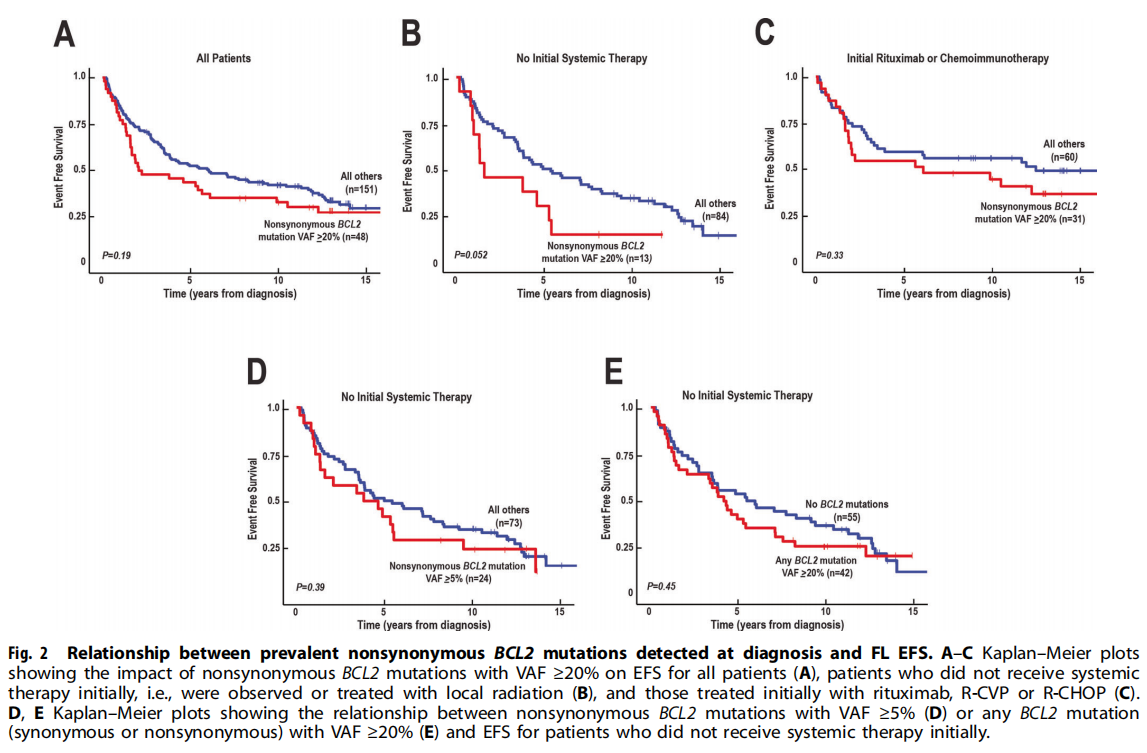
图2
将患者按初始治疗分组后,出现了几个显著差异。首先,在诊断时存在主要BCL2非同义突变的FLs不太可能被观察到(11% vs 74%,p=0.0026),并且倾向于与较高的FLIPI相关(p=0.032)(表1),提示较高的疾病风险。其次,在初始治疗不包括利妥昔单抗的患者(即观察或接受局部放疗的患者)中,在存在主要BCL2非同义突变的病例中,EFS有较低的趋势(图2,20个月vs 54个月,p=0.052)。相比之下,在初始治疗中接受利妥昔单抗治疗(利妥昔单抗单药治疗或免疫联合化疗)的患者中,无事件生存率较高(图2C vs. B),虽然EFS曲线在2年后分离,但主要BCL2非同义突变的FLs和无该突变的FLs之间的差异不具有显著统计学意义(图2C,p=0.33)。进一步分析表明,在初始治疗未包括利妥昔单抗的患者中,BCL2非同义突变和EFS之间的关联仅在其检测为主要突变(VAF≥20%)时观察到,而在其阈值较低(VAF≥5%)时未观察到(图2B vs. D)。此外,即使以20% VAF作为阈值,当考虑所有突变而不仅仅是非同义突变时,也未观察到统计学显著关联(图2B vs. E)。
在最初未接受全身性治疗的患者亚组中,即观察或仅接受局部放疗的患者,存在主要BCL2非同义突变也与较早的淋巴瘤相关死亡时间相关(图3A)。相反,在最初诊断时接受利妥昔单抗或化疗免疫治疗的患者中,在有主要BCL2非同义突变和无该突变的FLs之间,TTT(进展时间)难以区分(图3B)。尽管如此,如果诊断时存在主要BCL2非同义突变,即使在利妥昔单抗治疗的这一亚组中,超过10年的淋巴瘤相关死亡率也增加(图3B)。因此,与未携带BCL2非同义突变的FLs相比,携带BCL2非同义突变的FLs在整个队列中的OS显著较短(p=0.034,图3C)。相比之下,当考虑所有BCL2突变(同义和非同义)时,VAF≥20% BCL2突变与总生存期之间无显著关联(图3D)。此外,虽然趋势保持不变,但当VAF≥5%作为阈值时,BCL2非同义突变和总生存期之间的关联不再显著(图3E)。
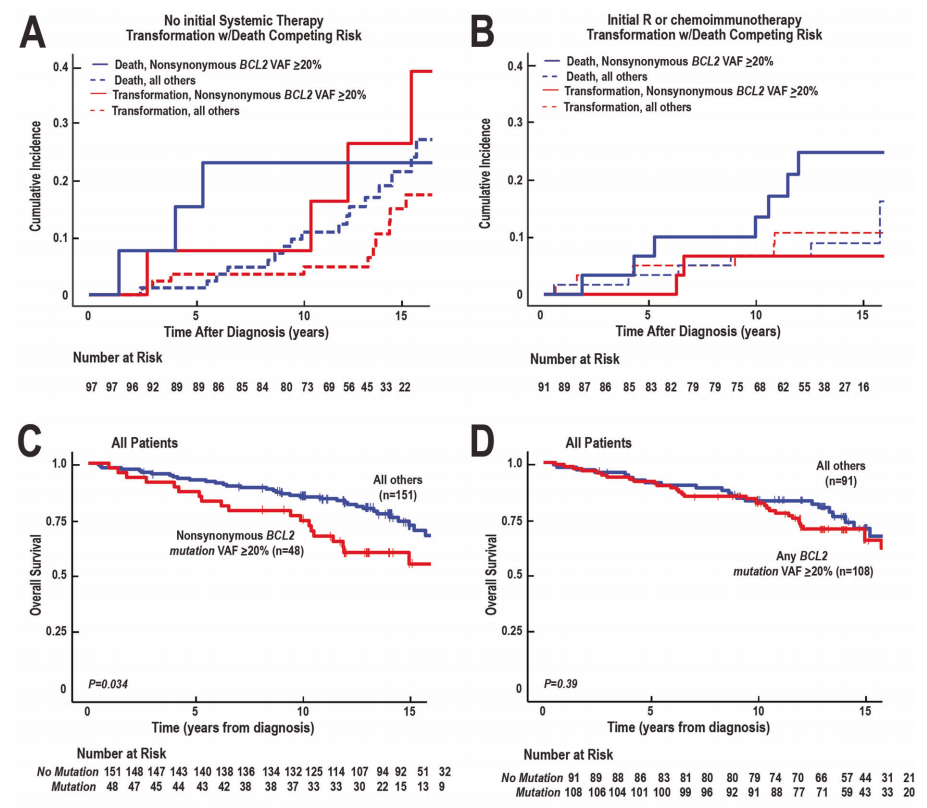
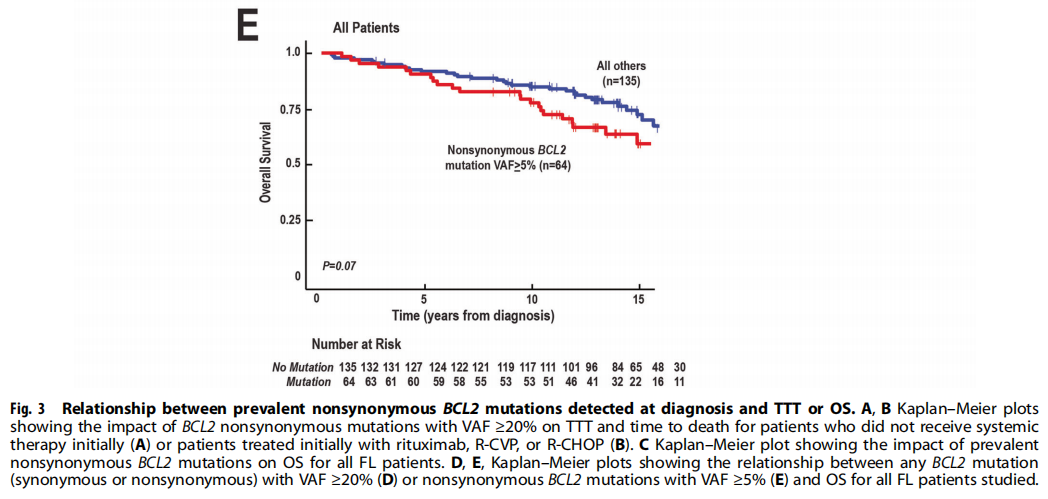
图3
讨 论
尽管FL的诊断和治疗取得了进展,但仍然迫切需要识别疾病可能快速进展的患者,以便考虑替代治疗。本文基于NGS检测FL中常见突变靶点。分析AICDA相关靶基因,发现大多数高VAF SNVs在BCL2中被检测到,这与其他研究一致。进一步分析表明,在最初未接受全身性治疗的患者中,VAF≥20%的BCL2非同义突变与进展风险增加相关,并且有证据表明整个FL队列的OS降低。这些观察结果对目前FL的治疗策略具有潜在意义。
在这项研究中,研究者分析了2002-2009年在单一机构接受治疗的199例新诊断的1级或2级FL患者。在这一队列中,患者被分为最初接受利妥昔单抗联合或不联合化疗的患者和最初未接受全身性治疗(接受观察或局部治疗)的患者。这些患者来自MER(先前描述的淋巴瘤患者数据库),并且筛选条件为在本研究分析时进行至少12年的随访。
在诊断时,72.5%的患者可检测到变异丰度>1%的BCL2突变。此外,分别在65.3%和52%的FLs中观察到变异丰度为5%或20%的BCL2突变。与之前的研究一样,这些SNVs大多发生在Cs和Gs,超过一半的编码区突变为非同义突变,绝大多数位于2号外显子(图1C、D)。之前的分析表明,许多这些非同义SNVs代表BCL2功能获得性突变。
当基于化疗免疫治疗背景下分析这些突变与预后之间的关联时,发现了几个值得关注的模式(表2)。首先,在最初未接受利妥昔单抗治疗(即观察或仅局部放疗)的患者中,与未携带这些主要BCL2非同义突变的FLs相比,携带VAF≥20% BCL2非同义突变的FLs发生进展的风险增加(图3A,HR 3.01,95%CI 1.04-8.78),这与研究者之前在未接受利妥昔单抗治疗的早期非重叠队列中获得的结果一致。
其次,VAF≥20% BCL2非同义突变与FL进展之间的关联因患者是否接受含利妥昔单抗的初始治疗而异。特别是,与未接受含利妥昔单抗治疗的患者相比,接受含利妥昔单抗治疗的患者发生FL进展的风险较低(图3A、B),这与早期研究报道的接受含利妥昔单抗治疗的患者发生FL进展的风险较低一致。此外,在最初接受含利妥昔单抗治疗的FL患者中,未检测到VAF≥20%非同义BCL2突变对进展产生影响(图3B)。
第三、在整个人群中,VAF≥20%的BCL2非同义突变似乎与较差的OS相关(图3C)。这似乎与总体人群的相似EFS不一致,无论FL是否携带或未携带主要非同义BCL2突变(图2A),但必须强调的是,FL是一种惰性疾病,通常在初始事件发生后采用多种方案进行治疗。即使在最初接受利妥昔单抗治疗的患者中,目前的结果提示,如果在诊断时存在主要BCL2非同义突变,则10年后的淋巴瘤相关死亡率仍会增加(图3B,蓝实线),提出了后线治疗耐药增加的可能性,这可能为图3C中两条生存曲线分离提供了解释。
结合之前的研究,目前的结果表明,高VAF BCL2非同义突变可能与FL进展增加和淋巴瘤相关死亡增加相关。这种影响在未将利妥昔单抗作为初始治疗的一部分患者(及观察或接受局部治疗)中似乎特别强(图3A)。由于FL患者在病程中接受了不同的序贯治疗,因此诊断时FL的任何基因组特征对生存产生影响是非常罕见的。
这些结果的潜在意义是,对VAF≥20% BCL2非同义突变进行测序可能有助于补充其他FL预后相关检测。特别是,如引言所述,12或24个月时的EFS评估具有预后意义,但无法在诊断时确定。m7-FLIPI评分可在诊断时进行评估,但在小体积病灶疾病中表现欠佳。相比而言,VAF≥20% BCL2非同义突变可在诊断时进行评估,以识别在未接受含利妥昔单抗初始治疗的情况下有早期进展和死亡风险的患者亚组(图3A),并提供FL人群的OS信息(图3C)。
研究者认为BCL2突变可能影响FL患者的生存,这一观点似乎与最近的其他研究不一致。然而值得注意的是,本研究在几个可能重要的方面不同于其他研究。首先,研究者没有统计所有BCL2突变(无论其丰度有多低),而是重点关注VAF≥20%的非同义SNVs,选择VAF≥20%这一阈值,是因为该阈值是研究者之前研究的检测下限。其次,本研究比其他研究的随访时间更长。经过约7年的随访,Huet等人在PRIMA研究中观察到基于BCL2突变状态的患者生存曲线持续分离,但未达到统计学显著性。相比之下,本研究对患者进行了长达16年的随访。在接受含利妥昔单抗初始治疗的患者中,存在主要非同义BCL2突变可能与10年后淋巴瘤相关死亡率增加相关(图3B),因此随访时长可能是两项研究之间的一个重要差异。
至少在某些情况下,非同义BCL2突变已被证明是功能获得性突变,会损害对细胞凋亡的诱导,因此研究者有兴趣推测利妥昔单抗如何部分减轻这些突变的影响。虽然据报道,利妥昔单抗诱导的细胞凋亡是通过抑制BCL2的线粒体凋亡途径发生的,但也有报道称利妥昔单抗可激活抗体依赖性细胞毒性,而这可能不依赖于BCL2。鉴于抗CD20抗体通过BCL2不敏感途径杀伤FL细胞,因此它们有望减弱BCL2功能获得性突变的不利影响。另一方面,BCL2突变的存在也使研究者有机会进一步研究替代疗法(如药物-树枝状聚合物偶联物BCL2/BCLXL抑制剂AZD0466)克服BCL2突变的影响。
尽管本研究有优势,但也有几个潜在局限性。首先,虽然目前的结果表明许多结论与利妥昔单抗时代之前的样本研究后报告的结论相似,但本研究没有第二个队列来验证当前的方法。其次,治疗方案不统一,这反映了本研究患者并未参与临床试验。虽然这是一个局限性,但本文描述的治疗方案反映了血液学界的临床实践,并在FLs患者中,比较了初始观察组与最初接受含利妥昔单抗治疗组中存在主要BCL2非同义突变的影响。第三,本研究侧重于初始治疗,未模拟二线或更后线治疗。第四,尽管本研究的样本是在利妥昔单抗广泛使用后收集的,但为了对患者进行长期随访,本研究并未纳入最近引入的药物(如苯达莫司汀或奥妥珠单抗)的患者样本。第五,目前的样本集相对较小。因此,研究者不能排除主要BCL2非同义突变对TTT有小影响的可能性,即使在接受利妥昔单抗治疗的亚组中也是如此。最后,这些观察结果的潜在机制基础需要进一步评估。研究者观察到变异体必须是非同义的且是主导地位,才能观察到相关性(图2、3),很容易推测具有较高VAFs BCL2变异的FLs在淋巴瘤发生过程中具有更好的抗细胞凋亡保护作用。然而,解决这些变异体抗凋亡作用的初步工作并没有对足够的SNVs进行研究,因此无法评估这种可能性。这些局限性为进一步研究FL的BCL2突变提供了依据。
如果进一步的研究继续提示主要BCL2非同义突变与FL的临床预后之间的关联,这可能对未来的FL治疗有几个潜在意义。首先,对于FL最初诊断后考虑观察或局部治疗的患者,BCL2测序可能有助于指导治疗方案的选择。其次,对于纳入新诊断FL患者的临床试验,根据BCL2突变状态对患者进行分层可能有助于确保预后不受BCL2突变状态与早期进展之间关联的混杂影响。最后,在以新方式开发靶向BCL2的疗法期间,为评估在主要BCL2非同义突变的FL患者亚群中是否能观察到特殊获益提供信息。
参考文献:Correia, Cristina et al. “Relationship between BCL2 mutations and follicular lymphoma outcome in the chemoimmunotherapy era.” Blood cancer journal vol. 13,1 81. 17 May. 2023, doi:10.1038/s41408-023-00847-1
不感兴趣
看过了
取消

人点赞

人收藏

打赏
不感兴趣
看过了
取消

打赏金额
认可我就打赏我~
1元 5元 10元 20元 50元 其它
打赏作者
认可我就打赏我~
扫描二维码
立即打赏给Ta吧!
温馨提示:仅支持微信支付!
已收到您的咨询诉求 我们会尽快联系您
