肾脏疾病的细胞和基因治疗还处于起步阶段。
PREFACE
前言
近日,制药巨头诺华(Novartis)宣布以35亿美元收购肾病精准药物研发公司 Chinook Therapeutics,引发了全球市场对于慢性肾病(CKD)治疗领域的关注。相比于癌症、心血管疾病治疗,CKD治疗领域的起步相对较慢;但随着近几年抗体药、ADC药物及细胞和基因治疗技术的飞速发展,以及人们对于慢性疾病治疗需求的提升,市场和资本逐渐将目光投向了CKD的精准治疗,期待在这个尚不拥挤的赛道有所作为。
慢性肾病(CKD)影响着全球约13%的人口,有着高发病率和高死亡率。例如,在糖尿病引起的终末期肾病患者中,5年内死亡率几乎与肺癌一样高,并甚至比结肠癌更为严重。
目前,绝大部分对肾脏疾病的治疗都是支持性治疗,还未出现针对其病因的根本性治疗。对于终末期肾病患者来说,透析或肾移植是仅有的治疗方式;然而,这些干预措施将会引发心血管疾病及免疫移植等并发症风险。此外,透析仅可恢复正常肾功能的5%-10%,且需要改变生活方式:包括每周三次或以上的数小时透析治疗。肾脏移植更是奢侈,大部分终末期肾病患者并不能在生命结束前等来可供移植的肾脏。
01、曙光初露但还有其他可能。
细胞和基因治疗已在近几年转化为一些成功的临床治疗方法,这无疑也将为慢性肾病(CKD)治疗带来启示。值得庆幸的是,CKD的许多遗传原因是已知的,约30%的CKD可归因于遗传性单基因疾病,例如多囊肾病(PKD)、艾波特综合征、胱氨酸病、法布里病、结节性硬化症、吉特曼氏综合症和胱氨酸尿症(表1)。临床医生通常可以在患者CKD发作前(例如儿童时期)就发现这些单基因肾病;然而,目前仅有例如酶替代等极少数有效疗法,它们一般效果短期且价格昂贵,大部分患者无法获得。
表1:遗传性肾脏疾病的流行及发病机制
如表1所示,肾脏疾病细胞和基因治疗的遗传靶点数量并不缺乏,细胞疗法或基因疗法或许可为CKD治疗带来新的希望。
例如,先天性肾病综合征最常由NPHS1或NPHS2突变引起,并通常导致严重疾病。有研究显示,在肾病蛋白缺陷(nephrin-deficient)的小鼠中诱导表达由NPHS1编码的肾病蛋白可预防围产期死亡。然而该研究也报告了不完全的表型挽救(phenotypic rescue)——大部分在第1周报告的正常肾脏病状在第6周进展为损伤和蛋白尿,其原因可能归咎为转基因表达的时间或在小鼠中使用了大鼠的肾病蛋白。尽管如此,考虑到这种疾病的严重程度,先天性肾病综合征依然是基因治疗的潜在靶标——虽然围产期或婴儿时期的基因治疗将要符合更高的安全性标准。
又例如常染色体显性遗传性多囊肾病(ADPKD)。ADPKD是最常见的单基因肾脏疾病,影响着全球约1200万患者,通常由于肾小管细胞携带PKD1或PKD2突变所致;因而靶向PKD1和PKD2的新疗法将是CDK细胞和基因治疗领域的重中之重。在一项2021年的研究中,研究者在小鼠模型中有条件地灭活PKD1或PKD2以诱导ADPKD发展,随后又诱导了这些失活基因的表达。此模型表现出增殖、炎症、细胞外基质沉积等ADPKD关键特征的快速逆转。在发生囊性肾的小鼠中,PKD基因的重新表达能够在体内逆转ADPKD。这表明即使是在囊性疾病发展后,基因治疗也有可能逆转ADPKD的症状。
02、挑战依然存在
当然,将细胞和基因疗法应用于CKD治疗,还有一些挑战需要解决。
1.靶向
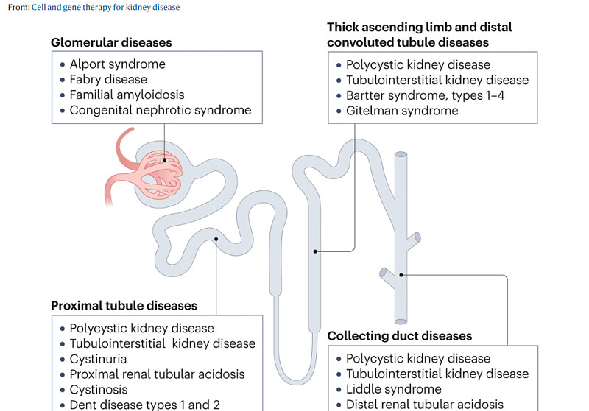
肾单元是一种高度复杂的结构,包含了多种特化细胞类型,这也部分解释了为什么与其他组织相比,对肾脏的基因治疗相对难以实现。例如,肝细胞占肝脏组织的80%以上,而肾脏中却至少含有26个独特的细胞种类。因此,将治疗药物递送到肾脏特定区域中,并靶向特定的细胞类型,一直是肾脏基因治疗的主要障碍。值得注意的是,各种遗传性肾脏疾病起源于肾单位的不同部分,意味着这些细胞类型中的任何一种都可能是治疗肾病所靶向的目标(图1)。从历史上看,病毒并未有效地传导肾脏,这意味着缺乏已知的病毒受体表达,进而增大了病毒靶向肾单元关键部位的难度。设计新的病毒衣壳或颗粒以靶向特定的肾细胞类型或将克服这一障碍。
图1:肾单位(肾脏最基本的功能单位)中,不同遗传性肾病的靶向位置
2.可及性
肾小球的尺寸排除(size exclusion)是肾脏治疗需要克服的另一个障碍。从血液通过肾小球进入尿腔的颗粒必须通过80-100纳米孔隙的肾小球内皮、3纳米孔隙的肾小球基底膜和32纳米长的足细胞足突。正因为如此,一般认为尺寸在10nm以上或重量大于50kDa以上的颗粒将被肾小球屏障主动排除。
病毒载体是当前许多基因疗法常用的递送方式,但在肾脏疾病的基因治疗中,三种最常见的载体的大小是必须要考虑的因素(图2)。最小的病毒载体——AAV——约25纳米;而最大的病毒载体——腺载体——的尺寸可达100纳米。除了尺寸排除外,很少有血清型的病毒载体被证明可靶向肾脏;因此,需要更高的病毒剂量才能达到明显的效果。常见的病毒受体似乎在肾脏中表达(例如AAVR/KIAA0319L用于AAV60、LDLR61用于常见VSV-G假型慢病毒),这意味着受体的亚细胞定位或肾脏的结构可能导致了肾脏转导的缺乏。考虑到这些考虑,纳米颗粒将是一种有前途的递送途径:它们的尺寸在1纳米和400纳米之间,且它们的结构及外部可修改,这都增强了对特定肾细胞类型的靶向性。
图2:肾病细胞和基因治疗中关于载体的考量
然而,尽管肾脏局部注射可能会改善基因和细胞治疗的特异性靶向,但全身给药更容易转化为临床;因而最终需要在治疗载体的肾脏靶向及个性化给药途径方面进行创新,以最大限度地减少毒性和脱靶效应。
03、新兴技术和未来展望
通过细胞和基因疗法进行有效的肾脏靶向和持续的表型校正的未来仍然充满希望。在过去的一年中,一些努力突出了该领域的技术改进和对肾脏病理生理学的进一步理解。
用于肾脏基因治疗的病毒和非病毒方法在最近获得了关注。
一项研究开发了一种涂有非抑制性纤溶酶原激活剂抑制剂1R(PAI-1R)的新型纳米颗粒,可选择性地靶向肾小球系膜细胞113.该纳米颗粒用小干扰RNA包装,以沉默人系膜增殖性肾小球肾炎大鼠模型中的转化生长因子-β1(TGFβ1)。全身性TGFβ1抑制剂可有效减缓CKD进展,但存在很大的炎症风险,因为TGFβ1也是关键的抗炎因子。从肾脏靶向的角度看,重要的是,PAI-1R包被的纳米颗粒能够通过肾小球血管窗孔,进而靶向系膜细胞,从而绕过肾小球滤过屏障的尺寸限制。研究者观察到,单剂量的纳米颗粒改善了肾功能:包括显著减少注射后5天的尿蛋白排泄和肾小球基质积累。尽管这项研究强调了肾小球肾炎的模型,但针对肾小球的纳米颗粒可能可以针对广泛的肾小球疾病进行修饰,包括遗传性和获得性病理。
病毒载体设计的优化也显著提高了肾病基因治疗的可行性。
病毒假分型(viral pseudotyping)——使用来自不同病毒的病毒包膜蛋白生产病毒载体的过程——允许研究人员改变病毒血清型的现有特异性。为了提高慢病毒的肾脏靶向性,最近的一项研究设计了带有寨卡病毒包膜的慢病毒假型——选择该包膜是由于其对肾小管上皮细胞具有较强的亲和力。
有趣的是,与慢病毒包膜对照相比,名为ZIKV-E的假型病毒在肾小管上皮细胞中的转导效率提高了100倍。ZIKV-E还显示出肝脏、大脑、心脏和脾脏内的高转导性,表明需要进一步修改假型包膜以进行选择性肾脏靶向。除了病毒包膜的假分型外,病毒的衣壳工程还为增强细胞和基因疗法的肾脏特异性提供了途径。对不同的衣壳文库进行高通量筛选可以鉴定肾脏靶向病毒。此外,鉴定促进肾脏转导的关键肽对于了解转导如何在肾脏内发生以及进而如何优化肾病细胞和基因治疗工作至关重要。
SUMMARY
小结
肾脏疾病的细胞和基因治疗还处于起步阶段。由于肾脏具有较多特异性细胞类型、肾小球的尺寸排除作用等原因,向肾脏递送药物仍然是肾脏疾病细胞和基因治疗的主要障碍。鉴于肾脏疾病的高疾病负担、高发病率和死亡率,急需例如细胞和基因治疗这样的分子疗法来从根本上进行治疗。希望在不久的将来,细胞和基因治疗能为肾病患者带来新的治疗选择,改变现有的肾病治疗模式。
参考来源:
Peek, J.L., Wilson, M.H. Cell and gene therapy for kidney disease. Nat Rev Nephrol 19, 451–462 (2023).
不感兴趣
看过了
取消

人点赞

人收藏

打赏
不感兴趣
看过了
取消






您已认证成功,可享专属会员优惠,买1年送3个月!
开通会员,资料、课程、直播、报告等海量内容免费看!

打赏金额
认可我就打赏我~
1元 5元 10元 20元 50元 其它
打赏作者
认可我就打赏我~
扫描二维码
立即打赏给Ta吧!
温馨提示:仅支持微信支付!
已收到您的咨询诉求 我们会尽快联系您
