北京、上海两地的LDT政策有何不同?
文章来源于基因江湖,作者九哥的小九九
最近,两份LDT官方文件陆续曝光,国内LDT正式进入实施阶段。
笔者从年初开始,便开始高频撰写、讨论有关LDT相关内容,并做了两次沙盘推演。
厘清LDT落地的几个关键问题
从LDT到“HDT”,到底发生了什么?
LDT新政对NGS/IVD行业的影响几何?
沙盘推演:LDT实施会改变什么?
LDT是解药还是毒药?
LDT与IVD之通俗演绎
2023年,写给NGS行业的15条箴言
始终强调,不管中国版LDT方案是否合理,企业基于现有的试点政策框架,思考如何去改变和适应,积极拥抱,才是更务实的态度。
上海文件曝光后,胖哥启发,有无比较过北京与上海两地文件异同,真是一个好方向。
从来没有无来由的改变,从意见征集稿,到北京101试点稿,到上海55号文,每一次的改变,都或多或少的反应政策制定者的考量、各种力量的博弈,从中也可以窥见到,哪里是红线,哪里或许还有讨论空间和探讨余地。
此外,各省LDT试点政策应已都在进行,北京与上海的文件,及其中的细节考量、变化,应对这些省市的政策制定者、高级别医院及专家有所启发。(提示:本文也可以作为专家拜访、讨论材料。)
故而,本文做一个北京101号文与上海55号文详细对比,文末附图片即存版、Excel对比原表,省去大家重复劳动(原文件是印刷版,无法直接复制,需手动识别、逐字核正),期望对大家的工作有所帮助。
01、两地文件差异提要
北京LDT试点文件是国家主管部门直接发文(规格更高),上海LDT试点是基于国家101号文基础上所做的针对上海区域具体实施规定;
两者核心内容一致,如都强调医疗机构在制备和使用阶段的主体责任;企业方可作为受托方,但仅限于本市具有相关资质的企业等。
相较而言,上海LDT政策文件更具实操性,要求更细致,具体可表现在:
强调 风险可控 的大前提;
提及 罕见疑难病诊治、出生缺陷诊断 等临床需求方向;
明确规定,试点医院LDT项目负责人和质量负责人, 不得相互兼任 ;
明确规定,学术审查机构人员的 专业组成和副高 以上职称 ;
明确规定,备案资料不全,主管部门应当 一次告知 申报者;
特别提及,发生 群体性投诉时 的风险管控;
特别提及,自制试剂包装标签上应当清晰标识“该产品为本医疗机构自行研制体外诊断试剂, 仅限本机构内使用。本机构 不包括医联体、医疗集团的其他医疗机构 ”。
明确规定,相关文件记录应当保存 不少于3年 ;
文件附件,含详细LDT 品种申请表 ;
02、两地文件细则对比详表
(表中以蓝字标识差异,红字标识相同)




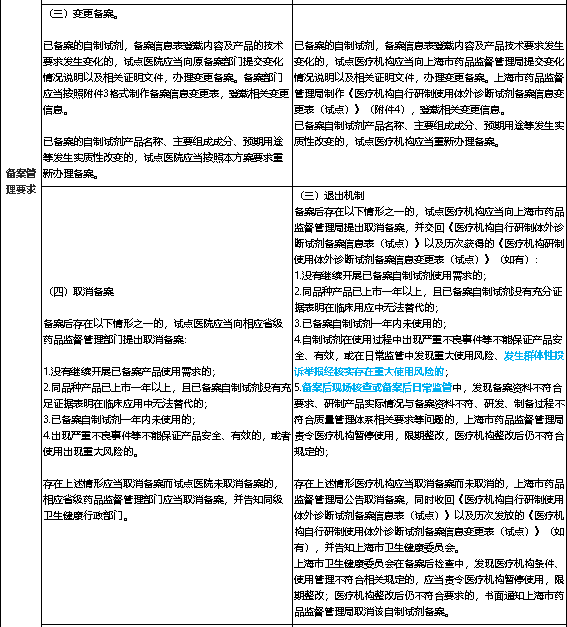



(因原件是印刷格式,无法直接复制文字,以上内容皆笔者手动识别校正处理,可能会存在少许文本错误,如需请参阅原文件。)
不感兴趣
看过了
取消
不感兴趣
看过了
取消
精彩评论
相关阅读





 打赏
打赏


















 010-82736610
010-82736610
 股票代码: 872612
股票代码: 872612




 京公网安备 11010802020745号
京公网安备 11010802020745号


