一文速览6月全球药品、器械最新获批情况 | 药械月报火石创造
医疗器械方面,FDA有1个通过上市前批准(PMA)途径首次上市的产品。境内没有公示三类医疗器械进入创新审批绿色通道,批准了3个创新器械上市,境内医疗器械审批集中在体外诊断试剂,共766项,占31.77%。
2022年6月,全球持续批准数十款新药。FDA批准10款新药(NDA/BLA),包含1款新获批的新分子实体药物(NDA:Type 1 - New Molecular Entity),1款生物制品药物(BLA);EMA新授权5款药品上市,其中有2款新活性物质(NAS);NMPA批准4个品规(3个品种)创新药上市,包含3款化药和1款生物制品,其中康方药业的卡度尼利单抗注射液为一款first-in-class产品。
医疗器械方面,FDA有1个通过上市前批准(PMA)途径首次上市的产品。境内没有公示三类医疗器械进入创新审批绿色通道,批准了3个创新器械上市,境内医疗器械审批集中在体外诊断试剂,共766项,占31.77%。
01全球药品获批情况
(一)美国FDA批准情况
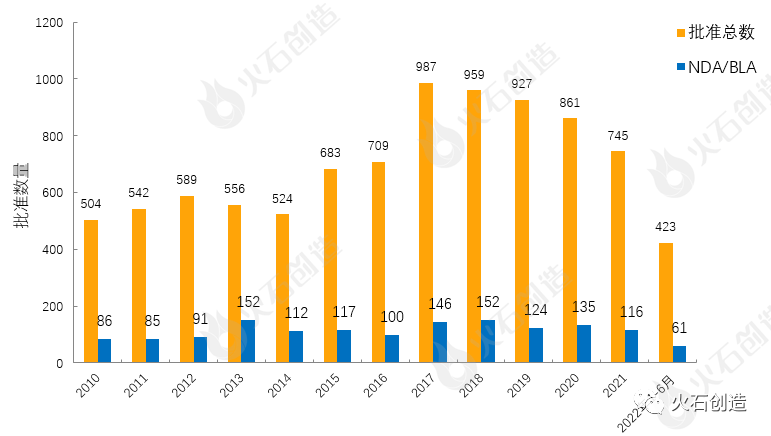
图1 2010—2022年6月FDA药物批准数量变化情况数据来源:美国食品药品监督管理局
如图1,截至2022年7月7日FDA官网披露,2022年6月FDA共完成62项药品首次批准(不包含暂时批准),其中NDA/BLA批准10款(不包含暂时批准),见表1。其中包括1款新获批的新分子实体药物(NDA:Type 1 - New Molecular Entity),1款生物制品药物(BLA)。
其中AMVUTTRA是一种RNAi疗法,是第一款也是唯一一款每3个月皮下注射一次治疗显示逆转神经病变损害的疗法,用于治疗遗传性转甲状腺素蛋白淀粉样变性伴多发性神经病(hATTR-PN)成人患者。
表1 6月FDA批准NDA/BLA药物列表
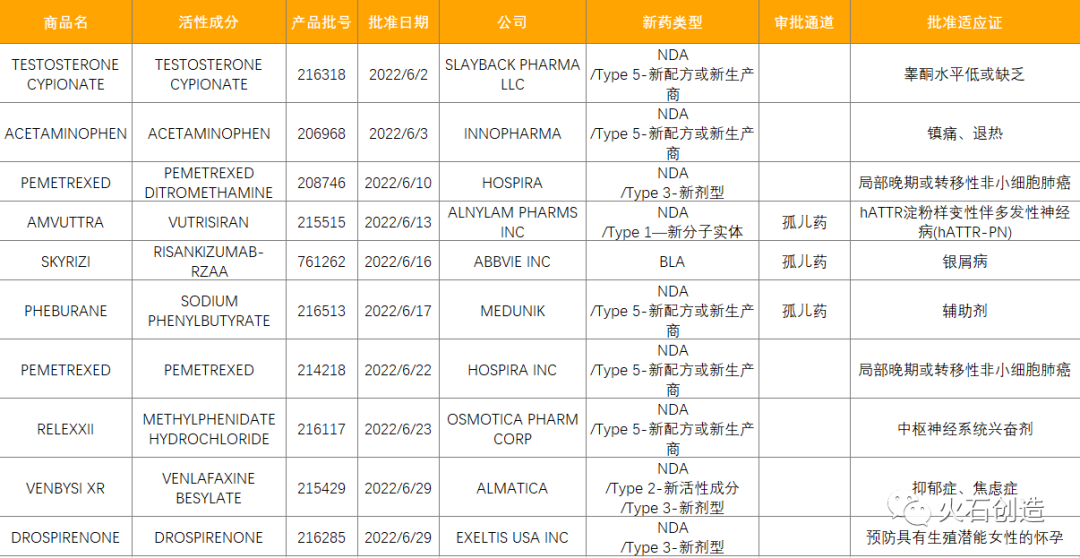
数据来源:美国食品药品监督管理局
(二)欧盟EMA批准情况
截至2022年7月7日EMA官网披露,2012年至2022年6月的推荐上市药品及新活性物质(NAS)数量情况见图2。2022年6月EMA未推荐药品上市。
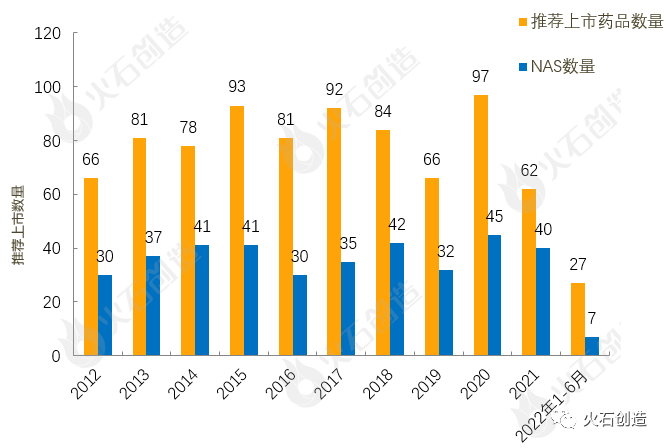
图2 2012—2022年6月EMA推荐上市药品数量变化情况
来源:火石创造产业数据中心
截至2022年7月7日,EMA在6月新授权5款药品上市,见表2。
其中罗氏的Lunsumio是首款可用于治疗滤泡性淋巴瘤(FL)的CD20xCD3 T细胞结合双特异性抗体,也是一种即用型(off-the-shelf)疗法,能为患者提供一种无化疗、现成的、固定疗程的治疗选择;Yselty是用于治疗子宫肌瘤的第一种也是唯一一种可提供灵活剂量方案的口服GnRH拮抗剂, 其活性成分linzagolix具有潜在同类最佳(best-in-class)的特征;Filsuvez是来自于桦树皮提取物的外用凝胶产品,是获批的首款治疗大疱性表皮松解症伤口的药物。
表2 6月EMA授权药物列表
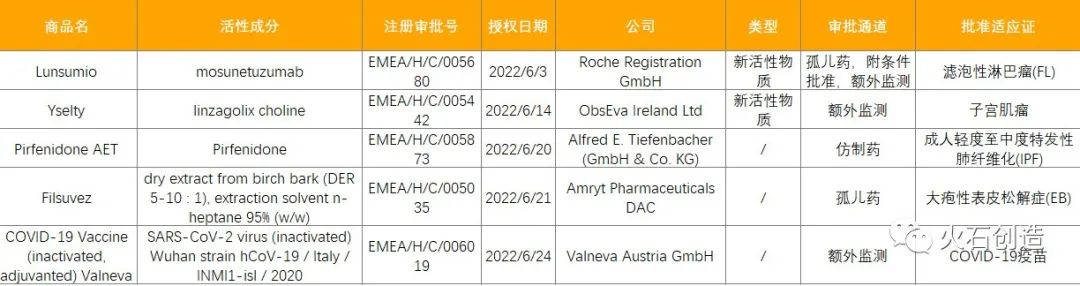
来源:火石创造产业数据中心
(三)NMPA批准情况
截至2022年7月7日NMPA披露,2022年6月共批准国产首次注册药品53件。按剂型去重后,共31个药品品种(不同厂家生产同一药物按同一品种计算)。本月有4个品规(3个品种)1类创新药获批,包含3款化药和1款生物制品。2022年6月NMPA批准的1类创新药情况见表3。
表3 NMPA批准的1类创新药获批列表
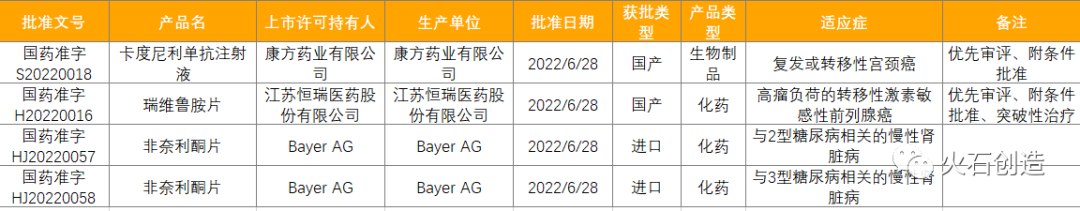
数据来源:国家药品监督管理总局
卡度尼利单抗注射液(商品名:开坦尼),是康方药业有限公司自主研发的全球首创PD-1/CTLA-4双特异性肿瘤免疫治疗药物,是我国自主研发的创新双特异性抗体。该品种通过优先审评程序和附条件批准程序上市,其上市为患者提供了新的治疗选择。
瑞维鲁胺片(商品名:艾瑞恩),是恒瑞医药在国内上市的第11款创新药,是我国自主研发的新型雄激素受体(AR)抑制剂。该上市申请于2021年10月被国家药监局按突破性治疗品种纳入优先审评审批程序。此次正式获批,将为中国前列腺癌患者带来新的治疗选择。
非奈利酮片(商品名:可申达/Kerendia),是拜耳公司研发的一种非甾体类、选择性盐皮质激素受体(MR)拮抗剂。在NMPA获批之前,已经在包括美国、欧洲在内的多个国家和地区上市,该药品在国内上市为2型糖尿病相关的慢性肾脏病成人患者提供了新的治疗选择。
(四)仿制药一致性评价情况
截至2022年7月7日CDE官网披露,CDE共承办药品一致性评价受理号4022个,2022年6月共新增承办105个受理号。截至2022年7月7日,共4305个品规上市药品通过一致性评价(包含视同通过1771个品规),本月共67个品规的药品通过一致性评价(包含视同通过20个品规),按剂型去重后,共43个药品品种。
目前一致性评价品种通过的注射剂共 1517个品规(238个品种),本月过评药品中共计35个品规(20个品种)的注射剂。2018年至2022年6月通过一致性评价数量见图3。
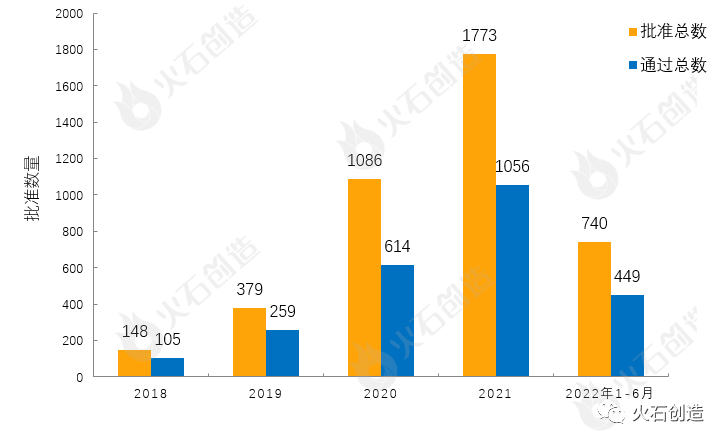
图3 2018年至2022年6月仿制药一致性评价批准数量变化情况
数据来源:国家药品监督管理总局
02全球医疗器械获批情况 (一)美国FDA批准情况
截至2022年7月7日,6月FDA共批准281个510(k)途径的产品,其中一类器械19个,二类器械258个,未分类4个。
通过对510(k)上市前通知的器械根据美国医学专业用途进行分类,结果发现,6月产品获批类型最多的为一般和整形手术器械、放射科器械、心血管器械、骨科器械与一般医院和个人使用类器械,见图4。
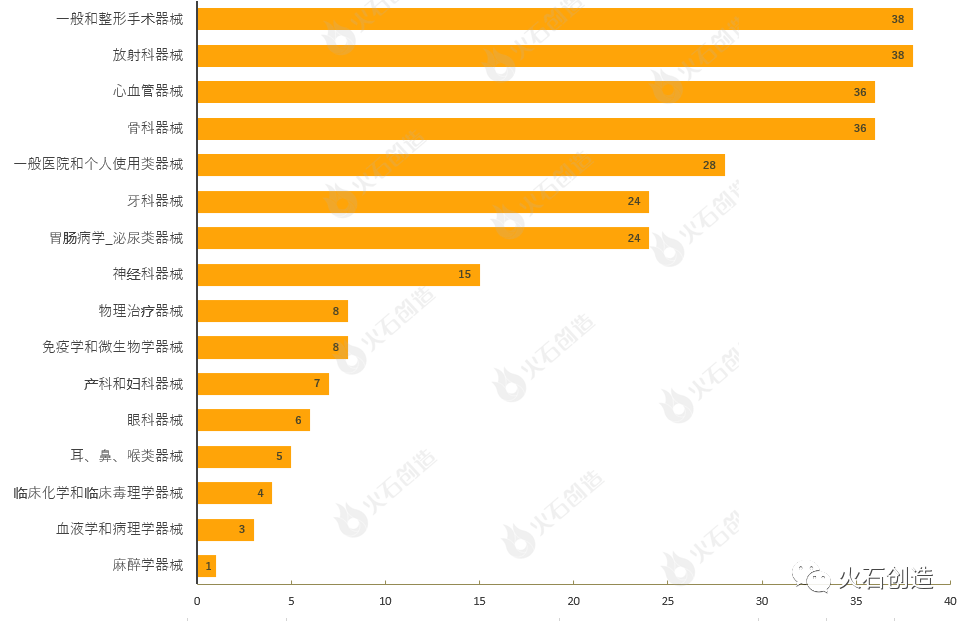
图4 6月通过FDA 510(k)途径获批上市产品类型分布情况
数据来源:美国食品药品监督管理局
2022年6月有1个通过上市前批准(PMA)途径首次上市的产品,见表4。
表4 2022年6月PMA首次批准的器械

数据来源:美国食品药品监督管理局
(二)境内批准情况
截至2022年7月7日,2022年6月国家局没有公示三类医疗器械进入创新审批绿色通道。
截至2022年7月7日,2022年6月国家局公示了3个三类创新器械获批上市,见表5。
表5 6月获批上市的三类创新器械
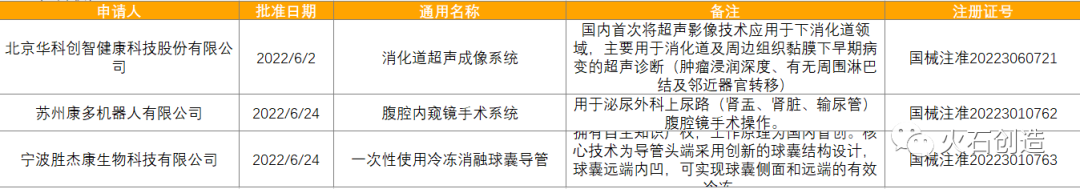
来源:国家医疗器械审评中心
截至2022年7月7日,2022年6月国家局共批准首次注册三类医疗器械产品165个,其中国产137个,进口28个。各省级药品监管部门3月共批准国产第二类医疗器械注册954个,一类备案医疗器械1196个。
火石创造产业数据中心显示,本期体外诊断试剂数量最多,共766项,占31.77%,基本上均为国产,为734项。除体外诊断试剂,批准注册类别数量排前三位的分别为注输、护理和防护器械,临床检验器械和物理治疗器械。
表6 6月国产、进口医疗器械批准注册类别数目分布情况
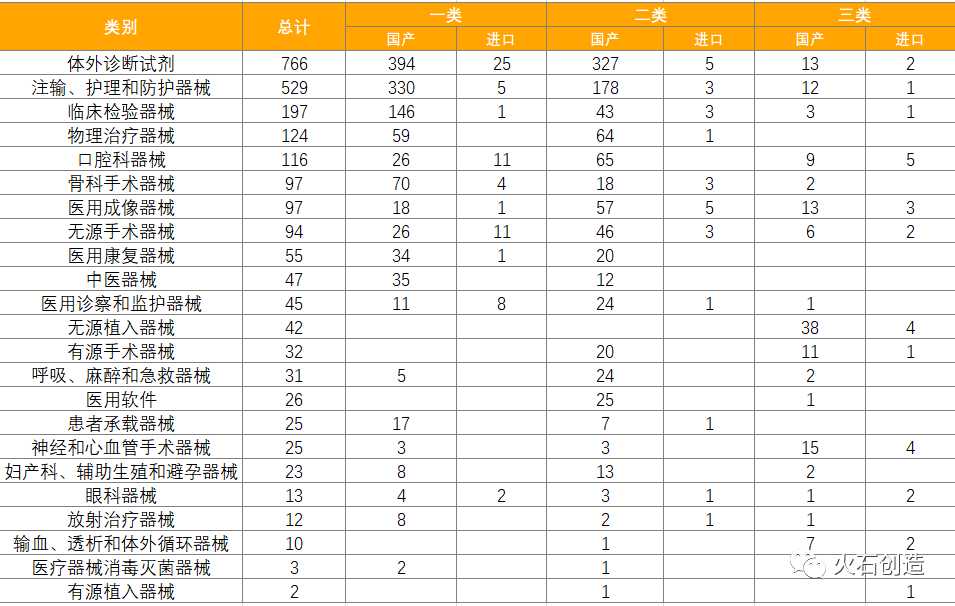
来源:国家医疗器械审评中心
从地域分布上,2022年6月国产二、三类注册产品批件最多的依次为湖南省(267件)、江苏省(256件)、广东省(137件)三个区域,见图5。
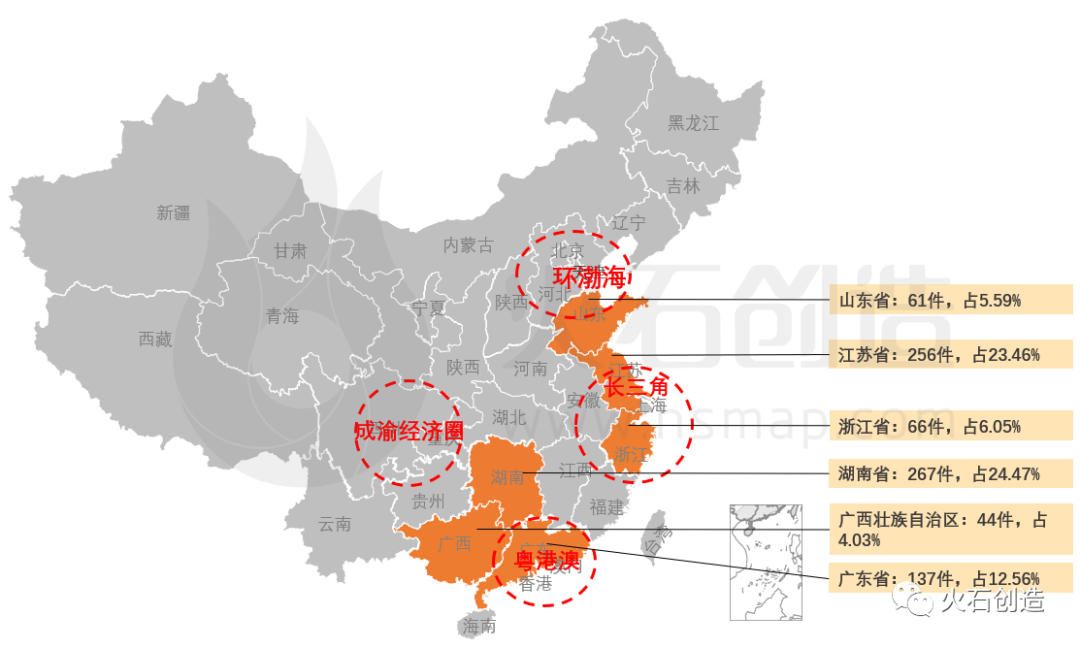
图5 :国产获批器械区域分布
来源:火石创造产业数据中心
—END—
作者 | 火石创造 毛琦琼
审核 | 火石创造 刘辉兴、殷莉
不感兴趣
看过了
取消

人点赞

人收藏

打赏
不感兴趣
看过了
取消


















 010-82736610
010-82736610
 股票代码: 872612
股票代码: 872612
 京公网安备 11010802020745号
京公网安备 11010802020745号










