肾结石的发展是相关生化途径发生紊乱的结果,如氧化应激、炎症、嘌呤代谢、尿素循环和血管生成。
肾结石形成的分子学机制
The Molecular Aspect of Nephrolithiasis Development
Cells 2021, 10(8), 1926; https://doi.org/10.3390/cells10081926
Received: 2 July 2021 / Revised: 24 July 2021 / Accepted: 27 July 2021 / Published: 29 July 2021
(This article belongs to the Section Cellular Pathology)
尿石症是继尿路感染和前列腺疾病之后的第三大泌尿科疾病,其特点是发生率在15%左右,并且还在持续上升。近几十年来观察到的肾结石发病率的增加很可能是由于所有工业化国家的饮食习惯(高含量的蛋白质、钠和糖饮食)和生活方式(减少体力活动)的改变造成的。此外,男性比女性更容易被诊断出患有肾结石。越来越多的证据表明,炎症、氧化剂-抗氧化剂失衡、血管生成、嘌呤代谢和尿素循环障碍可能在肾结石的发展中起关键作用。尿石症患者的特征是活性氧(ROS)水平升高,与对照组相比,脂质过氧化、促炎细胞因子以及促血管生成因子的产物。此外,研究表明,与嘌呤代谢和尿素循环有关的酶的缺乏和紊乱可能是沉积物形成的原因。ROS 的产生表明,肾结石的病程可能还受到炎症、嘌呤代谢和尿素循环的影响。另一方面,ROS 的过度产生可能会诱导血管生成的激活,从而允许沉积物聚集。ROS 的产生表明,肾结石的病程可能还受到炎症、嘌呤代谢和尿素循环的影响。另一方面,ROS 的过度产生可能会诱导血管生成的激活,从而允许沉积物聚集。ROS 的产生表明,肾结石的病程可能还受到炎症、嘌呤代谢和尿素循环的影响。另一方面,ROS 的过度产生可能会诱导血管生成的激活,从而允许沉积物聚集。
关键词: 氧化应激 ; 炎症 ; 血管生成 ; 嘌呤代谢 ; 尿素循环 ; 肾结石
一、简介
尿石症是继尿路感染和前列腺疾病之后的第三大常见泌尿系统疾病。最近来自意大利、德国、苏格兰、西班牙、瑞典、日本和美国等七个国家的流行病学总结显示,肾结石的发病率为每 10 万人 114-720 人,患病率仍为 1.7-14.8%。上升 [ 1 ]。据观察,肾结石发病率在过去 30 年中急剧增加,这可能是由于环境变化,包括饮食不足和身体活动受限 [ 2 ]。根据美国国家健康和营养检查调查 (NHANES) 的数据,2007 年至 2010 年期间,美国自报的肾结石患病率增加了近 3 倍。 3、4 ] 。_ 在英国,2000 年至 2010 年间,尿石症的终生患病率增加了 63% [ 5 ]。先前的流行病学研究表明,形成结石的倾向因性别、种族和地理而异。直到最近,男性泌尿道沉积物的发生率是女性的 2-3 倍。然而,最近的研究表明,男女之间的这种差异正在消失,例如,1970 年至 2000 年间,在明尼苏达州(美国),肾结石发病率的男女比例从 3.1 下降到 1.3 [ 6 ]。有人提出,女性结石发病率增加的原因可能是生活方式和饮食的改变,导致女性肥胖增加,这是泌尿道沉积物形成的已知危险因素 [ 7 ]。同样,中国和日本等东方国家的数据也观察到了向“西方饮食”的饮食转变,表明肾结石的风险增加了 [ 8 , 9 ]。“西方饮食”的特点是大量摄入动物蛋白,导致尿液中钙、草酸盐和尿酸的排泄增加,从而易患肾结石。另一方面,与一些西方国家的饮食相比,中国传统饮食中的动物蛋白含量较低,蔬菜的比例较高,因此可能有利于预防沉积物的形成[ 8 ]。一项针对男性人群的流行病学研究证实,改变饮食习惯与调节日本患肾结石的风险之间存在密切关系。BMI(体重指数)的增加与肾结石风险增加呈正相关 [ 9 ]。因此,肾结石的危险因素包括饮食中蛋白质、钠(盐)和糖含量高,以及体力活动减少等。此外,减少液体和钙的消耗以及增加草酸盐的消耗可能会促进肾结石的形成 [ 10 , 11 , 12 , 13 , 14 ]。患肾结石的风险不仅与动物蛋白的高供应有关,还与食品生产商添加的某些违禁物质有关。2008年9月,婴儿奶粉三聚氰胺污染丑闻曝光。三聚氰胺是一种化学物质,用于增加稀释牛奶中的氮含量,使其具有更高的蛋白质含量以通过质量控制测试。食用牛奶中含有的三聚氰胺的受害者人数估计为 240,000 人,其中 6 名儿童死于肾结石和其他肾脏损害,约有 54,000 名儿童住院。根据世界卫生组织的数据,在食用三聚氰胺的受害者中,82% 的儿童年龄在两岁或以下 [ 15 , 16、17、18 ] 。_ _ _ 如上所述,结石患病率也与种族和民族差异有关。先前的分析证实,非西班牙裔白人的结石风险最高 (10.3%),其次是西班牙裔 (6.4%) 和非西班牙裔非裔美国人 (4.3%) [ 3 ]。此外,肾结石的发病率也与环境因素有关。炎热、干旱的气候可能导致肾结石的发展 [ 10 ]。此前在美国进行的流行病学研究表明,平均气温较高的地区发生尿路结石的风险最高。因此,这种相关性可能表明全球变暖可能会影响结石的形成 [ 4 , 11 ]。Brikowski 及其同事(2006 年)预测,基于全球变暖的影响,生活在被指定为肾结石形成高风险地区的人口比例将从 2000 年的 40% 增加到 2050 年的 56%,并高达 70%到 2095 年 [ 12 ]。此外,流行病学数据还表明,结石发病率可能具有季节性特征。在温暖的夏季月份观察到的结石发病率高于寒冷的冬季月份 [ 13 ]。此外,糖尿病、代谢综合征、心血管疾病和肥胖等多种全身性疾病也是肾结石 的 危险 因素 [ 14,19,20,21 ] 。
不幸的是,肾结石的特点是复发风险高。第一次肾绞痛后的 5 年自发复发率为 35% 至 50% [ 22 ]。此外,如果患者不应用预防性治疗,继发性结石形成的复发率估计为每年 10-23%,5-10 年为 50%,第一次发生后 20 年为 75%[ 23 ] . 不幸的是,由于肾结石发作的重复性,尿路结石会导致多种并发症,从急性到慢性,包括肾盂肾炎、油籽、尿路感染、肾功能不全,甚至是尿路癌 [ 24 , 25 ]。有趣的是,随着尿路结石和膀胱癌的发病率均呈上升趋势,尿路结石可能参与了膀胱癌的发展。一项荟萃分析证实,与健康对照组相比,尿石症患者患膀胱癌的总体风险增加了 1.87 倍。此外,Yu 等人。(2018 年)表明,膀胱结石患者比肾结石患者显示出更高的膀胱癌风险(2.17 对 1.39)[ 26 ]。
除了环境和病因因素外,最近的研究还表明遗传因素在尿石症发展机制中的作用。据报道,16% 至 37% 的已形成肾结石的患者有结石的阳性家族史,而对照组为 4% 至 22% [ 27 ]。流行病学研究证实,有肾结石家族史的患者较年轻时会形成结石。此外,具有阳性家族史的患者从疾病发作起就有相对较多的结石发作。与没有家族史的患者相比,一组有阳性家族史的患者的平均复发时间间隔明显缩短 [ 28 ]。
由于世界人口中尿石症的高发病率和复发率,它也与高昂的医疗费用有关。2000 年美国治疗尿石症患者(包括住院、门诊和急诊服务)的总费用估计为21 亿美元。此外,这一费用在 1994 年至 2000 年期间增加了 50% [ 29 ]。有趣的是,据估计,到 2030 年,由于肥胖和糖尿病患病率的上升,美国的尿石症患者的护理费用每年将增加12.4 亿美元[ 30 ]。
尽管对肾结石的发病机制进行了广泛的研究,但其分子基础仍不清楚。另一方面,越来越多的证据表明炎症、氧化剂-抗氧化剂失衡、嘌呤代谢、尿素循环以及血管生成障碍可能在泌尿道沉积物的形成中起重要作用。因此,在本文中,我们旨在根据现有文献阐明上述生化途径在肾结石发病机制中的作用。
2. 氧化应激
活性氧 (ROS) 是高活性化合物,作为信号分子发挥关键作用,但也会对蛋白质、脂质、碳水化合物和核苷酸造成损害,导致各种疾病的发展,包括肾结石 [ 31 , 32 ]。在稳态条件下,ROS在调节细胞间和细胞内信号传递过程中发挥重要作用。例如,由于细胞中的低反应性、选择性和持续可用性,在 ROS 中,超氧离子和过氧化氢在腺苷酸环化酶和磷脂酶 C 途径中发挥调节剂的作用 [ 31 , 33 ]。ROS还参与受体功能的调节,主要是那些含有-SH(硫醇)基团的受体。大多数情况下,硫醇基团位于配体结合位点。由于 ROS 的作用,硫醇基团发生氧化,导致配体结合位点失活,从而导致整个受体失活。另一方面,ROS 可以增强转运蛋白的活性,例如 5-脂氧合酶,它是受刺激的淋巴细胞产生的自由基的额外来源 [ 34 , 35 ]。ROS 的另一个重要活性与吞噬细胞(粒细胞、单核细胞、巨噬细胞)对病原体的反应(氧爆炸现象)有关 [ 36 ]。ROS也参与免疫过程的调节。先前的研究表明,ROS 增强了 T 淋巴细胞的活化并诱导白细胞粘附到内皮,这使得它们能够从循环系统渗透到炎症反应的部位 [ 31 , 33 , 37 ]。此外,过氧化氢浓度低会刺激活化 B 细胞 (NF-κB) 的核因子 kappa-轻链增强子的活性,从而激活许多基因的表达,包括细胞因子(白细胞介素-IL-1β 或 IL-6 )、硫氧还蛋白、SOD(超氧化物歧化酶)[ 38 ]。ROS还影响细胞存活、衰老和死亡。低浓度的 ROS 调节细胞分化过程,使它们适应变化的条件,而暴露于较高浓度的自由基会诱导细胞凋亡,从而消除那些严重受损并可能对身体构成风险的细胞。 33、39 ] 。_ 如上所述,高浓度的 ROS 对细胞是危险的。除其他外,自由基的有害影响表现在它们氧化蛋白质、核酸和脂质的能力 [ 33 , 40 , 41 ]。蛋白质氧化可导致多肽链断裂、残基氨基酸改变的出现以及蛋白质二聚体或聚集体的形成。因此,这些变化导致酶、调节蛋白或膜转运蛋白的功能活性丧失 [ 42 , 43 , 44 ]。发生不可逆变化的蛋白质会被蛋白酶选择性地去除,但随着细胞老化和蛋白水解活性降低,它们会在细胞中积聚,导致其永久性损伤。ROS,包括羟基自由基和氧单重态,也会破坏嘌呤和嘧啶碱基、残基的糖或导致连接核苷酸的磷酸二酯键断裂 [ 40 , 41 , 45 ]。由于 ROS 活性,核酸链断裂或其氧化修饰产物,包括 8-羟基-2-脱氧鸟嘌呤和 8-羟基鸟嘌呤,可发生在线粒体和细胞核中。由于靠近线粒体呼吸链,线粒体 DNA 比核 DNA 更容易受到氧化损伤 [ 41 , 46 , 47 ]。脂质,尤其是多不饱和脂肪酸,也特别暴露于高浓度的 ROS。由于脂质过氧化,形成修饰的、受损的脂质分子。在多不饱和脂肪酸的过氧化产物中,丙二醛或 4-羟基壬烯醛是最常见的 [ 48 ]。此外,脂质过氧化产物,如 4-羟基壬烯醛,会对蛋白质活性产生不利影响。4-羟基壬烯醛相关蛋白(如谷胱甘肽转移酶)在构象和功能上发生变化 [ 49 ]。此外,脂质过氧化产物也会影响细胞膜的物理特性,导致膜酶和转运蛋白的活性受到抑制。此外,它们可以诱导巨噬细胞中 2 型环氧合酶 (COX-2) 的表达,并激活这些细胞的炎症潜能 [ 50 ]。然而,细胞已经发展出针对 ROS 过量产生的防御机制。这些系统包括酶、降解 ROS 和非酶促低分子化合物、抗氧化剂,它们在活性氧的作用下构成对细胞重要的分子的防御屏障 [ 51 ]。ROS的两个面 如图1 所示。
图 1. 在稳态条件下,活性氧自由基以对细胞安全的量释放,可诱导细胞分化和凋亡,影响一氧化氮的合成、释放或失活,并刺激葡萄糖向细胞转运。通过增加毛细血管壁的渗透性,它们确保炎症反应的正确过程。ROS 执行的最重要任务之一是调节细胞间和细胞内的信号传输过程。较高浓度的这些分子会导致毒性细胞损伤,从而导致它们的破坏。除其他外,自由基的有害影响表现在它们氧化蛋白质、核酸和脂质的能力上 [ 51 ]。
肾脏中 ROS 的主要来源是 NADPH 氧化酶,特别是在存在血管紧张素的情况下 [ 52 ]。晶体聚集和滞留是肾结石形成的关键事件,与体内自由基活性密切相关。草酸钙 (CaOx) 晶体(最常见的尿路结石诊断形式)的沉积导致肾素上调和血管紧张素 II 的产生,从而导致 NADPH 氧化酶活化,从而加剧 ROS 的产生。然后,ROS 通过 P38 丝裂原活化蛋白激酶 (-MAPK)/JNK 激活转录因子,包括活化 B 细胞的核因子 kappa-轻链增强子 (NF-κB)、活化蛋白-1 (AP-1 ) 和生长因子,包括 TGFβ Runt 相关转录因子-2 (RUNX-2) 和 osterix。因此,激活 ROS 诱导的转录会导致异前列腺素和前列腺素的产生,从而,可以调节炎症反应(汗)。ROS 诱导的 NF-kB 还可能调节编码粘附分子、COX-2 和促炎细胞因子、肿瘤坏死因子-α (TNF-α)、白细胞介素 6 (IL-6) 和 C 反应的基因的表达蛋白质(CRP)。然后,恶性循环机制中的这些因素可能会额外激活 NADPH 氧化酶,并可能刺激 ROS 的产生,这可能会损害内皮功能。 53 ]。
除了 NADPH 氧化酶,ROS 的线粒体产生是肾结石病理生理学中与肾沉积物形成相关的肾损伤的下一个罪魁祸首。在心脏之后,肾脏的特点是线粒体含量和耗氧量第二高,因此被认为是人体最耗能的器官之一。这种高能量需求对于正常的肾功能是必要的,包括从血液中清除废物、重新吸收营养、维持酸碱平衡、调节血压以及维持电解质和液体的平衡。然而,并非肾脏结构的每个元素都具有相同的能量需求。对能量需求最高的肾脏结构是近端小管,它重新吸收通过肾小球的 80% 的滤液。因此,与其他类型的肾细胞相比,它们需要额外的主动转运机制,因此,它们比肾脏中的任何其他结构都具有更多的线粒体。因此,近端小管的正常功能取决于线粒体感知和响应营养供应和能量需求变化的能力。 54、55、56、57、58 ] 。_ _ _ _ _ _ _ 如引言中所述,CaOx 是最常见的诊断,这主要是尿液中草酸盐浓度增加的结果。先前的研究表明,高草酸盐水平会导致肾脏氧化应激,这可能在肾细胞损伤的发生和进展中起关键作用 [ 59 , 60 ]。体外和体内研究表明,草酸盐可能会干扰线粒体中的电子传递链,从而可能导致自由基的泄漏 [ 61 ]。随后的一项研究表明,一水草酸钙晶体可能会抑制近端肾小管细胞中的线粒体呼吸链 [ 62 ]。已经表明,由于暴露于草酸盐,线粒体增加了 ROS、脂质过氧化物和氧化硫醇蛋白的产生 [ 63 ]。CaOx 晶体的沉积也可能通过增加细胞神经酰胺水平对线粒体造成损害。神经酰胺导致线粒体损伤的后果可能是过氧化氢产生增加、谷胱甘肽消耗和线粒体膜电位降低,从而导致半胱天冬酶激活,最后诱导细胞凋亡 [ 64 ]。此外,Niimi 及其同事 (2014) 提出线粒体损伤可能是由线粒体内膜中线粒体通透性转换孔 (mPTP) 的打开引起的 [ 65 ]。mPTP 开放可能是钙超载和氧化应激的结果。因此,mPTP 开放可能导致氧化磷酸化解偶联并损害细胞内 ATP 水平,最终导致坏死细胞死亡 [ 65 ]。
因此,促氧化剂和抗氧化剂失衡可能导致肾结石的发展。因此,肾结石患者的特点是脂质过氧化物增加,而血清中亚硝酸盐和 α-生育酚水平降低 [ 66 ]。先前的研究证明,肾结石患者的特征是尿液中促氧化损伤标志物水平升高,包括 8-羟基脱氧鸟苷(8-oxoG,一种 DNA 氧化损伤的标志物)和硫代巴比妥酸反应物质(TBARS,一种脂质过氧化)[ 67 ]。此外,一项动物研究表明,肾结石可能与上皮一氧化氮合成酶 ( eNOS ) 表达减少和诱导型一氧化氮合成酶增加有关。iNOS ) 在乙二醇 (EG) 处理的大鼠的肾髓质中表达,这被称为肾脏中 CaOx 形成的既定模型。此外,EG 处理的大鼠的肾皮质和髓质中的硝基酪氨酸(由活性氮物质介导的酪氨酸硝化产物)水平增加 [ 68 ]。eNOS的 mRNA 表达降低可能是骨桥蛋白 (OPN) 活性变化的结果。OPN 可能下调人肾近端小管上皮细胞中一氧化氮合酶 ( NOS ) 的表达 [ 69 ]。先前的结果表明,OPN 将草酸钙结晶引导至草酸钙二水合物相,与草酸钙一水合物相相比,草酸钙与肾小管上皮细胞的粘附性更低[ 70 ]。因此,ROS 暴露与NOS mRNA 水平降低有关,同时与OPN mRNA 水平升高有关 [ 69 ]。此外,Khan 等人。(2002) 发现肾脏中OPN表达增加与 CaOx 在肾脏中沉积后尿 OPN 排泄增加相关 [ 71 ]。
另一方面,肾结石的形成可能与抗氧化水平降低有关,包括α-胡萝卜素、β-胡萝卜素和β-隐黄质[ 72 ]。此外,在儿科人群中,一项研究结果证实肾结石与氧化应激有关。儿科患者的尿液总抗氧化状态 (TAS) 和总氧化状态 (TOS) 高于对照组 [ 73 ]。持久的氧化条件可能会导致抗氧化水平的增加,因此高 TAS 值可能表明存在持续的氧化应激。此外,在肾病患者中还观察到抗氧化酶活性降低,包括超氧化物歧化酶(SOD,-7%)、谷胱甘肽过氧化物酶(Gpx,-20%)和谷胱甘肽-S-转移酶(GST,-13%)。石头。因此,由于机体无法抵抗 ROS 的破坏性影响,抗氧化酶活性降低会加剧上述疾病 [ 74 ]。另一方面,手术切除肾结石可能有助于降低丙二醛(MDA,29%)和增加 Gpx 活性(50%),达到接近对照组水平的值 [ 74 ]。先前的研究表明,过氧化作用的升高和硫醇水平的消耗可能导致草酸盐结合活性的增加和对肾小管细胞的损害,进而促进成核、晶体粘附和结石的聚集 [ 66 ]。因此,在特发性 CaOx 结石病例中,观察到表明肾小管损伤的高水平肾酶,例如 γ-谷氨酰转肽酶、血管紧张素 1 转换酶、β-半乳糖苷酶和 N-乙酰-β-D-氨基葡萄糖苷酶 (NAG) ),以及脂质过氧化的产物,包括 MDA。此外,尿 NAG 排泄与 8-OHdG 浓度呈正相关 [ 67 , 75 ]。因此,肾小管损伤与活性氧的产生密切相关。
有趣的是,MnSOD(锰超氧化物歧化酶)多态性可用作识别有尿石症风险的个体的工具。先前的一项研究表明,Ala-9-Val MnSOD多态性的 Ala/Ala 基因型降低了风险,而 Val/Val 基因型与肾结石风险增加有关 [ 76 ]。
表 1 总结了与肾结石相关的促氧化和抗氧化失衡因素。
复合(缩写)
生理作用
肾结石病程中的功能障碍
样品
引文 如前所述,ROS 过度产生会导致炎症的发展。另一方面,炎症也可能与结石形成直接相关。在尿石症的过程中,已经观察到 CaOx 晶体可以通过与肾小管细胞结合而保留在肾脏中,然后聚集成大的形式 [ 77 ]。因此,肾脏沉积物可以刺激肾细胞分泌炎症介质,例如单核细胞趋化蛋白-1 (MCP-1,也称为 CCL2) 和 TNF-α [ 78 , 79 ]。先前的研究表明,与肾结石发展相关的肾细胞损伤和炎症与尿石症患者尿液中 IL-6 的增加有关 [ 80 , 81 , 82 ]。此外,对含有结石的肾脏进行的肾活检显示肾脏组织中IL-6和MCP-1的mRNA 表达增加[ 83 ]。此外,Hasna 及其同事 (2015) 发现,患有尿石症的糖尿病患者的 CRP 和 IL-6 水平高于没有尿石症的糖尿病患者 [ 84 ]。血清 CRP 水平升高与年轻人自我报告的肾结石发病率相关 [ 85 ]。3. 炎症
如前所述,ROS 过度产生会导致炎症的发展。另一方面,炎症也可能与结石形成直接相关。在尿石症的过程中,已经观察到 CaOx 晶体可以通过与肾小管细胞结合而保留在肾脏中,然后聚集成大的形式 [ 77 ]。因此,肾脏沉积物可以刺激肾细胞分泌炎症介质,例如单核细胞趋化蛋白-1 (MCP-1,也称为 CCL2) 和 TNF-α [ 78 , 79 ]。先前的研究表明,与肾结石发展相关的肾细胞损伤和炎症与尿石症患者尿液中 IL-6 的增加有关 [ 80 , 81 , 82 ]。此外,对含有结石的肾脏进行的肾活检显示肾脏组织中IL-6和MCP-1的mRNA 表达增加[ 83 ]。此外,Hasna 及其同事 (2015) 发现,患有尿石症的糖尿病患者的 CRP 和 IL-6 水平高于没有尿石症的糖尿病患者 [ 84 ]。血清 CRP 水平升高与年轻人自我报告的肾结石发病率相关 [ 85 ]。3. 炎症
孙等人。(2010) 发现肾结石患者的特征是尿液中炎症生物标志物水平升高,包括 IL-6、IL-8/CXCL8(白细胞介素 8/趋化因子(CXC 基序)配体 8)、RANTES/CCL5(受激活、正常 T 细胞表达和分泌/CC 基序趋化因子配体 5)、MCP-1/CCL2、Mig/CXCL9(γ/趋化因子(CXC 基序)配体 9 诱导的单核因子)和 IP-10/CXCL10(CXC 基序趋化因子配体 10/干扰素 γ 诱导蛋白),其中最敏感的是 IL-8/CXCL8。此外,复发性结石患者的尿 IL-8 水平高于首次出现肾绞痛的患者 [ 86 ]。肾结石可刺激肾小管上皮细胞和免疫细胞通过 TLR4(Toll 样受体 4)和 TLR2(Toll 样受体 2)分泌诱导型趋化因子,包括 IL-8/CXCL8、RANTES/CCL5 和 MCP-1/CCL2。 87、88 ] 。_ 作为对 TLR2 和 TLR4 激动剂的反应,树突状细胞可以产生 RANTES/CCL5、IP-10/CXCL10、IL-8/CXCL8、MIP-1α/CCL3 和 MIP-1β/CCL4 [ 89 ]。反过来,NK细胞分泌的IFN-γ可以刺激常驻组织细胞产生IP-10/CXCL10和Mig/CXCL9。然后,IP-10/CXCL10 和 Mig/CXCL9 可以将活化的 T 细胞引导回发炎的组织中 [ 90 ]。从肾小管上皮细胞和树突状细胞中早期产生这些趋化因子对于塑造肾脏的免疫反应至关重要 [ 91 ]。IL-8/CXCL8 也可能将中性粒细胞募集到炎症部位,而 MCP-1/CCL2 可能会募集单核细胞、记忆 T 细胞和 NK 细胞 [ 92 ]。此外,MCP-1/CCL2可诱导肾小管上皮细胞分泌IL-6,表达细胞间粘附分子-1[ 93 ]。因此,沉积物引起的肾损伤可能会引发“趋化因子到细胞因子到趋化因子”级联反应( 图 2 )。此外,结石形成青少年尿液中的巨噬细胞炎症蛋白 1β(CCL4、MIP-1β)和白细胞介素 13(IL-13)水平高于对照组。MIP-1 家族参与趋化因子受体激活,包括 CCR1(CC 趋化因子受体 1 型)和 CCR5(CC 趋化因子受体 5 型),调节急性和慢性炎症 [ 94 ]。反过来,IL-13 可能会阻止单核细胞产生起始炎性细胞因子,包括 IL-6,并增加主要组织相容性复合物 (MHC) II 类表达 [ 95 ]。
图 2。 启动“趋化因子到细胞因子到趋化因子”级联。肾结石可能含有大量内毒素,可刺激肾小管上皮通过 TLR4 分泌趋化因子,包括 IL-8/CXCL8、RANTES/CCL5 和 MCP-1/CCL2。IL-8/CXCL8 在中性粒细胞的募集中起关键作用,而 RANTES/CCL5 以白细胞募集到炎症部位而闻名。反过来,MCP-1/CCL2 募集单核细胞、记忆 T 细胞、NK 细胞,并诱导 IL-6 并表达肾小管上皮细胞分泌的细胞间粘附分子 1。此外,活化的 NK 细胞释放 IFN-γ,它可以刺激常驻组织细胞产生 IP-10/CXCL10 和 Mig/CXCL9,它们最终负责将活化的 T 细胞引导回发炎的组织。因此, 86、87、88、89、90、91、92、93 ] 。
先前的多态性分析表明,肾结石患者中IL-1β启动子区域的 T/T (-511) 基因型和IL - 1RA的 I/II (410/240) 基因型的频率高于对照组。[ 96 ]。同样,在土耳其人群中,多态性分析表明 IL-1RN 和 IL-1β (-511) SNP 与尿石症相关 [ 97 ]。陈等人。(2001) 表明位于 IL-1 的多态性与成人尿石症的发展和严重程度有关 [ 98 ]。另一方面,肖等人。发现中国维吾尔族儿童IL-1RN、IL-1β(-511)和IL-1β(+3954)多态性基因型的发生无显着差异[ 99 ]。下一个多态性位于 IL-18 基因中。+105A/C IL-18 多态性的 A/C + C/C 基因型增加了尿石症的风险 [ 100 ]。同样,相同多态性的 C/C 基因型与伊拉克人群中肾结石的高风险相关 [ 101 ]。
与肾结石发展相关的炎症介质总结 见表 2 。
表 2. 肾结石诊断中与炎症相关的潜在生物标志物。
调解员(缩写)
生理作用
肾结石病程中的功能障碍
样品
引文
 4. 嘌呤代谢
4. 嘌呤代谢
另一个与结石形成相关的代谢途径是嘌呤代谢( 图 3 )。先前的研究已经证实,嘌呤代谢相关酶的缺乏可能是肾结石发展的一个原因。其中之一是腺嘌呤磷酸核糖基转移酶 (APRT) 缺乏症,导致腺嘌呤(通常会转化为 AMP)转化为 2,8-二羟基腺嘌呤 (2,8-DHA),其溶解度比尿酸低 50 倍,并导致肾结石形成 [ 102 ]。同样,次黄嘌呤-鸟嘌呤磷酸核糖基转移酶 (HPRT) 缺乏症,称为 Lesch-Nyhan 综合征,是一种 X 连锁疾病,可导致尿路沉积物形成。该综合征与鸟嘌呤和次黄嘌呤向尿酸的降解增加有关 [ 103 ]。尿液中的大量尿酸会导致尿酸结晶形成。另一方面,黄嘌呤氧化酶 (XO) 缺乏也会导致肾结石形成,因为黄嘌呤和次黄嘌呤不能代谢成尿酸,因此已被证明会增加尿中黄嘌呤和次黄嘌呤的浓度 [ 104 ]。黄嘌呤是尿液中排泄的所有嘌呤中溶解度最低的一种,尿黄嘌呤水平升高会导致沉淀和结石形成。因此,尿酸和氧嘌呤的血浆水平反映了嘌呤代谢紊乱。低尿酸血症患者的特点是尿酸水平低于 80 µmol/L(正常水平为 300-360 µmol/L),黄嘌呤和次黄嘌呤的血浆浓度分别比正常高 7 到 20 倍和 1.5 到 3.5 倍[ 103 ]。先前的结果还表明,磷酸核糖焦磷酸合成酶 (PRPS) 的超活性可能导致肾结石或膀胱结石的发展,从而可能导致急性肾功能衰竭 [ 105 ]。
图 3。 嘌呤代谢包括三个步骤:从头合成、补救和分解途径。从头合成是一个多步骤过程,需要 PRPS、四种氨基酸、一种 PRPP、两种叶酸和三种 ATP 的贡献来合成一磷酸肌苷 (IMP)。IMP可被5'-核苷酸酶(5'NT)直接催化为肌苷,然后嘌呤核苷磷酸化酶(PNP)将肌苷转化为次黄嘌呤。HPRT 利用 PRPP 作为共底物,分别催化从嘌呤碱基次黄嘌呤和鸟嘌呤中回收合成单磷酸肌苷 (IMP) 和单磷酸鸟苷 (GMP)。HPRT 作用导致次黄嘌呤和鸟嘌呤的积累,它们在分解途径中通过 XO 和黄嘌呤脱氢酶 (XDH) 转化为尿酸。此外, 106 ]。
与肾结石形成相关的嘌呤代谢酶总结 见表 3 。
表 3. 肾结石诊断中与嘌呤代谢途径相关的潜在生物标志物。
因子(缩写)
生理作用
肾结石病程中的功能障碍
生物样品
引文
 5. 尿素循环和多胺生物合成
5. 尿素循环和多胺生物合成
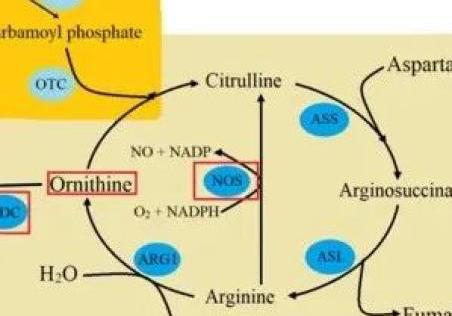
尿素循环( 图 4 )包括涉及尿石症进展的关键途径。肾脏中克雷布斯循环的调节可能通过改变微环境的 pH 值和诱导 ROS 生成来促进结石形成 [ 107 ]。肾结石患者的特点是血浆氨基酸水平高于对照组,包括牛磺酸、天冬氨酸、羟脯氨酸、谷氨酸、甘氨酸、丙氨酸、胱硫醚、鸟氨酸和赖氨酸 [ 108 ]。另一方面,在 CaOx 患者的尿液中观察到尿鸟氨酸和酪氨酸水平降低。L-鸟氨酸是参与尿素循环和多胺生物合成的关键氨基酸 [ 109 , 110 ]。鸟氨酸转化受鸟氨酸脱羧酶 (ODC) 调节 [ 111 ]。先前的研究表明,ODC表达可能受到位于ODC基因内含子 1. +316 [ 112 ] 位置的多态性的调节。该 SNP 位于两个 c-myc 转录因子结合位点和一个导致ODC基因表达降低的稀有等位基因(等位基因 A)之间 [ 113 ]。然而,ODC的+316 G/A多态性不能作为结石病的遗传生物标志物。SNP 基因型的频率在尿石症组和对照组中相似 [ 114 ]。此外,在尿石症过程中,NOS的变化已经观察到表达,这在上面关于氧化应激的 第 2 节中进行了讨论。
图 4。 尿素循环包括位于肝细胞和细胞质线粒体的五个反应。第一步涉及通过氨基甲酰磷酸合成酶 I (CPS I) 将 CO 和氨转化为氨基甲酰磷酸。氨基甲酰磷酸和鸟氨酸(在肾结石患者中观察到血浆水平升高和尿液水平降低)通过鸟氨酸转氨甲酰酶 (OTC) 与瓜氨酸结合。然后鸟氨酸转位酶将瓜氨酸从肝细胞线粒体转运到细胞质中。瓜氨酸与天冬氨酸和精氨基琥珀酸盐反应。该反应由精氨基琥珀酸合成酶 (ASS) 催化。精氨琥珀酸通过精氨琥珀酸裂解酶 (ASL) 转化为精氨酸。最后,精氨酸酶 (ARG1) 将精氨酸水解成尿素和鸟氨酸。另一方面,L-精氨酸可被 NOS 氧化降解为 L-瓜氨酸和一氧化氮 (NO)。在肾结石病程中,减少已观察到eNOS表达。此外,来自尿素循环的鸟氨酸可以通过多胺生物合成途径中的鸟氨酸脱羧酶 (ODC) 转化。ODC多态性可能与肾结石风险增加有关 [ 115 ]。
6. 血管生成基因
有趣的是,血管生成障碍可能对肾结石的发展至关重要。晶体粘附是肾脏沉积物形成的关键步骤之一。细胞基质离结石最近,主要由透明质酸 (HA) 组成,通过细胞表面受体,包括 CD44 和 CD168 与各种细胞内和细胞外分子相互作用。反过来,CD44 对许多其他配体具有亲和力,例如骨桥蛋白、胶原蛋白和基质金属蛋白酶 (MMP)。细胞外基质 (ECM) 的这些成分是有效的晶体结合分子,它们参与肾结石晶体的粘附和内化,导致聚集、生长,并最终形成结石 [ 116 , 117 ]。此外,ROS 可能会诱导 MMPs 活化增加 [ 118 , 119 ]。高 ROS 水平导致转录因子 1 (AP-1) 水平增加和 NF-kB 核转位增加,导致MMPs表达增加,包括MMP - 9 [ 120 ]。反过来,MMPs 水平的增加强化了 ECM 重塑的过程。此外,MMP(特别是 MMP-9)降解胶原蛋白和骨桥蛋白的裂解产物会刺激趋化反应并促进炎症细胞募集,这也与肾结石的形成有关 [ 121 ]。MMP-9 刺激树突细胞的迁移并诱导 E-钙粘蛋白表面受体 CD103 在树突细胞上的切割,促进上皮-间质转化,从而允许沉积物粘附和聚集 [ 122 ]。
以前关于血管生成在肾结石发展中的作用的研究主要集中在MMP - 9多态性的分析上。MMP - 9启动子区(rs3918242)的C1562T多态性纯合子T/T在肾结石患者中比对照组更常见。此外,与具有 C/C 基因型的肾结石患者相比,具有 C/T 和 T/T 基因型的肾结石患者的特征是血清 MMP-9 水平、TOS、MDA 和尿酸 AS 升高。因此, MMP - 9中 C1562T 多态性的 T/T 基因型与结石风险增加和氧化应激过程加剧有关 [ 123 ]。此外,位于MMP - 9 (rs1056628) 3'-非翻译区的多态性与中国人群对特发性钙肾结石的易感性有关。SNP的C/C基因型增加了肾结石的风险。此外,该 SNP 在MMP9的 miR-491-5p 识别位点中的 A→C 转换增强了基因表达,可能通过抑制 miR-491-5p 结合。因此,C/C 基因型肾结石患者的 mRNA 和蛋白 MMP9 水平高于 A/A 基因型 [ 124 ]。下一个与肾结石风险调节相关的多态性是 Bst UIC/T。VEGF的这种多态性基因位于上游第-460个核苷酸。这种VEGF多态性的 T 等位基因在结石病患者组中比对照组更常见 [ 125 ]。因此,所研究的 SNP 可用作预测肾结石发展的潜在生物标志物。
7. 结论
综上所述,肾结石的发展是相关生化途径发生紊乱的结果,如氧化应激、炎症、嘌呤代谢、尿素循环和血管生成。我们的审查使我们能够确定所分析途径的肾结石病理机制中涉及的共同因素。一方面,促炎细胞因子、尿素循环障碍和嘌呤代谢促进了活性氧的产生。另一方面,ROS 的过度产生可能会诱导促炎因子的活性,包括 IL-6 和 TNF-α,以及促血管生成因子。因此,氧化应激可能允许维持炎症微环境、ECM 重塑并最终导致沉积物的聚集。然而,
不感兴趣
看过了
取消

人点赞

人收藏

打赏
不感兴趣
看过了
取消






您已认证成功,可享专属会员优惠,买1年送3个月!
开通会员,资料、课程、直播、报告等海量内容免费看!

打赏金额
认可我就打赏我~
1元 5元 10元 20元 50元 其它
打赏作者
认可我就打赏我~
扫描二维码
立即打赏给Ta吧!
温馨提示:仅支持微信支付!
已收到您的咨询诉求 我们会尽快联系您
