
在肿瘤治疗领域,科学家们不断探索和开发更有效、毒性更低的创新疗法,以提高局部肿瘤控制率、患者存活率和生活质量。
在肿瘤治疗领域,科学家们不断探索和开发更有效、毒性更低的创新疗法,以提高局部肿瘤控制率、患者存活率和生活质量。硼中子俘获疗法(BNCT)是几十年前提出的一种创新的放射治疗方法,从理论上讲,它可能是许多类型癌症的理想治疗方法。首先,为患者注射含硼(Boron)药物,药物和癌细胞有很强的亲和力,并很快聚集在肿瘤细胞内,而很少在正常组织中聚集。然后对患者的肿瘤部位进行热中子(thermal neutrons)照射。当热中子被肿瘤细胞中的10B俘获时发生裂变,产生了破坏力较大的α粒子和反冲的7Li核,可以精确地杀死肿瘤细胞。
BNCT选择性杀伤肿瘤细胞的机制
BNCT是一种基于硼中子俘获的裂变反应。非放射性同位素10B原子通过吸收低能(<0.5eV)中子(热中子)分裂成α粒子(4He)和反冲核(7Li),这些粒子在短距离(<10μm)内释放能量。而单个细胞的大小约为10μm,所以硼中子俘获反应发生于单个细胞内。从理论上讲,10B可以选择性聚集在恶性肿瘤细胞中,利用上述反应产生的两种重粒子(4He和7Li)选择性地杀死肿瘤细胞,同时保护正常组织免受损害。(图1&图2)。
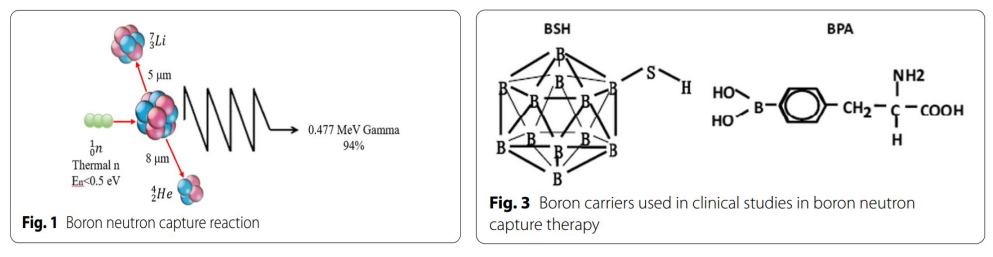
图1:硼中子俘获反应的原理;图3:BSH和BPA的结构
BNCT的基本放射生物学因素
在BNCT中,三种具有不同线性能量传递(LET)特性的直接电离能传递给肿瘤和正常组织,它们是:
(a)硼中子俘获反应产生的高LET的 α粒子和7Li离子:10B+1n=7Li+4He(α)+2.79 MeV;
(b)中子束及氢中子俘获反应中产生的低LET γ射线:1H+1n=2H+γ+2.2MeV;
(c)快中子散射和氮原子俘获热中子产生的高LET质子:14N+1n=14C+1p+580keV。即使物理剂量相同,高LET和低LET粒子的生物效应也不同。在相同的物理剂量下,由于沿轨道的电离密度较高,高LET粒子比低LET粒子产生更强的生物效应。这通常被称为相对生物效应,类似于参考放射源(如X射线)的吸收剂量与产生相同生物效应的其他放射源的吸收剂量之比。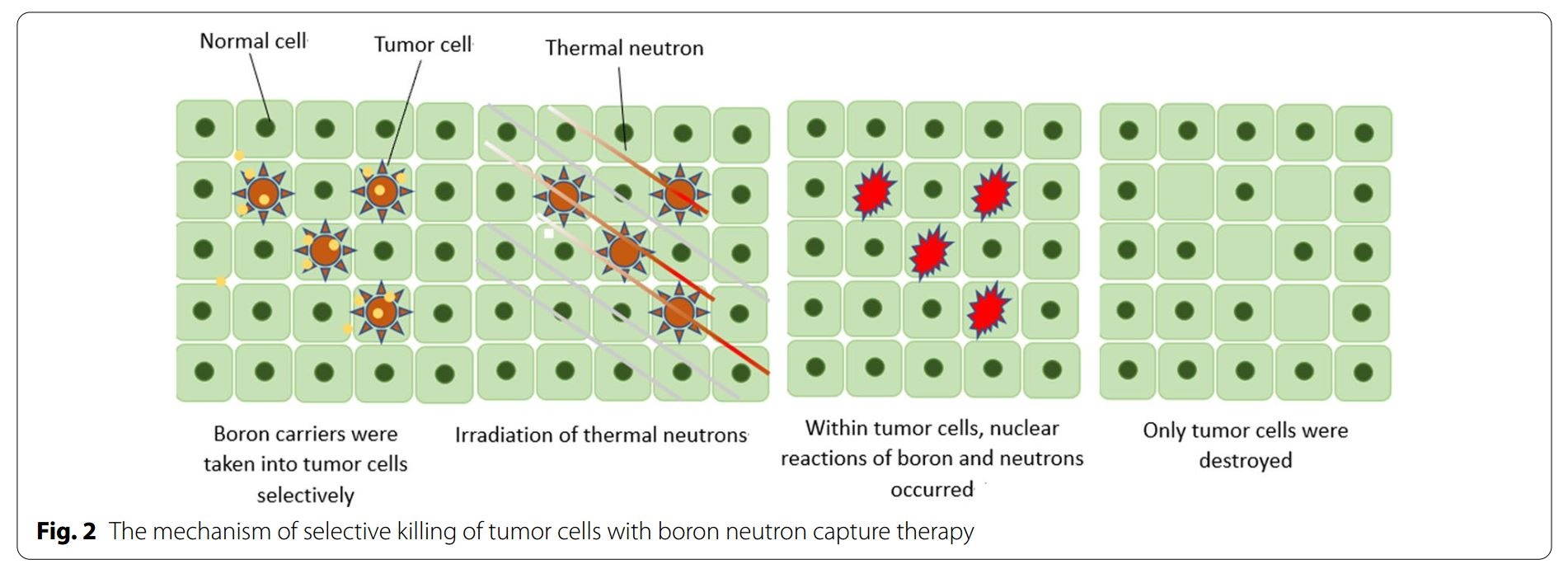
图2:BNCT选择性杀伤肿瘤细胞的原理
硼的载体
BNCT杀灭肿瘤细胞的两个重要因素是10B和热中子。其中最重要的是10B浓度较高且选择性进入肿瘤细胞。在研制硼载体时需要考虑以下三个重要因素:
(1)肿瘤组织中10B的浓度范围达到20-35μg 10B/g;
(2)肿瘤/正常组织10B浓度比和肿瘤/血液10B浓度比大于3-5;
(3)足够低的毒性。然而,目前还没有一种硼载体能完全满足上述要求。
在20世纪50年代至60年代初,BNCT的发展处于初级阶段,研究者使用硼砂、硼酸及其衍生物作为硼载体进行了初步的临床研究以评价BNCT对脑肿瘤的疗效。Farr等首次使用硼砂作为硼载体,对GBM患者进行BNCT。但该研究并未成功,这是由于第一代硼载体不具有肿瘤特异性,中子照射后正常组织受损严重。且肿瘤细胞内硼浓度不足。随后,研究者致力于开发具有肿瘤细胞选择性的硼载体。硼苯丙氨酸(BPA)和硼碳酸钠(BSH)脱颖而出,发展成为第二代硼载体。BPA由Synder等合成,其结构与酪氨酸类似,参与特定蛋白质的合成,因此在肿瘤的快速增殖过程中选择性积聚于肿瘤生长相关的蛋白质中,从而选择性聚集于肿瘤细胞。BPA对脑肿瘤有效,因为除肿瘤细胞外,脑内很少有增殖活跃的细胞。将BPA与果糖结合(BPA-F)可显著提高BPA在生理pH下的水溶性,进一步提高进入细胞的能力。BSH由Solow等在1967年合成,并证实其具有脑肿瘤特异性。BSH通常含有10个及以上的硼原子,在日本等国家开展了多项针对胶质瘤的临床研究。
由于BPA主要针对增殖的肿瘤细胞,且在肿瘤细胞中产生更高的硼浓度,因此较BSH具有更大的肿瘤杀伤能力和更小的副作用。BPA和BSH联合应用,可使硼的分布更均匀,以获取更好的疗效。另外,改善给药方式,如同时输注甘露醇,采用聚焦超声技术,或通过对流增强输送装置进行瘤内给药,可显著提高脑肿瘤对BPA和BSH的摄取能力。另外,利用18F标记的BPA可通过PET置管显示10B在人体内的分布,为制定BNCT治疗方案提供指导。目前,BPA是治疗高级别胶质瘤和复发头颈部肿瘤的首选硼载体,第二代硼载体代表了BNCT技术发展的里程碑。
第二代硼载体由于分子特性存在缺陷,并不是理想的硼载体。随着越来越多的研究者投入硼载体的研发,第三代硼载体显示出旺盛的生命力。第三代硼载体分为两类:含硼小分子药物和含硼纳米药物。含硼氨基酸衍生物是很有前途的小分子硼载体,可通过氨基酸代谢途径实现肿瘤特异性。从BPA和18F-BPA衍生出多种新型的硼载体。Nomoto等将BPA与聚乙烯醇结合(PVA-BPA),增强肿瘤摄取,提高疗效。Li等合成了一种新型的硼化酪氨酸FBY,18F-FBY具有较强的代谢稳定性,且肿瘤特异性较高,是具有较大潜力的PET显像用硼载体。在纳米载体方面,含硼胶束是近年来研究的热点。嵌段共聚物(Block Copolymer)在水中可以自组装成球形的核壳聚合物胶束。它们制备简单,生物相容性高,稳定性好,水溶性强。与PEG共聚可有效延长血液循环时间,被广泛应用于药物成像和靶向递送。Sumitani合成的含硼聚乙二醇聚乳酸延长了血液循环时间,并显示出高肿瘤摄取率,且制备简单,具有较好的临床应用前景。Shi等利用MPEG-PLGA胶束包覆硼卟啉TBPP。制备了含硼纳米药物BPN。胶束包衣不仅将TBPP从血细胞中分离出来,降低药物毒性,而且提高了肿瘤特异性,克服了传统含硼卟啉的缺点。BPN的药代动力学也可以通过荧光成像和PET成像来研究,以便于开发治疗方案。
硼的来源
1、反应堆中子源
根据能量大小,核反应堆中产生的中子可分为热中子(慢中子)(En<0.5 eV)、超热中子(0.5 eV<En<10keV)和快中子(En>10keV)。热中子是BNCT中最重要的中子源,可以参与硼中子俘获反应。现有BNCT研究中,均利用了反应堆中子源。但反应堆的前景不乐观,其造价高,占地面积大,运维费用高,改造难度大,有些已经关停或面临关停风险。专为BNCT研发的新一代反应堆中子源可解决此项问题,例如在我国北京建设的一个低功率反应堆,该反应堆成本较低,安全性高,可在医院内部使用。
2、基于加速器的BNCT中子源(AB-BNCT)
通常,质子或氘离子首先由加速器加速,然后用锂或铍靶轰击,通过裂变产生中子。对于AB-BNCT来说,最有希望的核反应是用2.5 MeV的质子轰击7Li靶,产生中子的最大能量和平均能量分别为0.8 MeV和0.4 MeV,比反应堆产生的中子能量低。
目前正在探索多种不同类型的中子源加速器,如低能直线加速器、高能回旋加速器、高能直线加速器和高能同步加速器在BNCT中的应用。与反应堆中子源相比,AB-BNCT有许多优点:
(a)当不需要中子源时,加速器容易关闭。而反应堆遗留大量的永久性放射性物质;
(b)加速器较反应堆更容易获批建造;
(c)易于安装和维护;
(d)费用较低;
(e)放疗科对加速器的使用经验丰富。
(f)加速器产生的中子源的质量远远高于反应堆产生的中子源的质量。

图4:中国自主生产的基于加速器的BNCT装置
现在,多个临床AB-BNCT开发项目正在进行中;日本住友重工(SHI)于2009年与京都大学合作,开发了基于回旋加速器的中子源,2012年京都大学启动了首个利用此设备进行的临床研究。我国也在2020年8月成功研制了AB-BNCT的实验装置。
总 结
BNCT是一种集核物理、化学、生物、医学等多学科于一体的治疗方法。与传统的放射治疗相比,BNCT是一种很有前途的癌症治疗工具,因为它对肿瘤的辐射高度集中,不会损伤正常组织。经过数十年的发展,BNCT已取得了长足进步。然而,该技术尚处于处于起步阶段。需开展更大规模的随机对照临床研究以评估BNCT的安全性和有效性。并与其他放疗方式进行对照研究。希望在不久的将来,BNCT可成为肿瘤治疗领域的一大突破。
敬请注意:本文仅供相关专业人员学习参考之用,文中的所有信息均不作为诊断和治疗疾病的依据。如出现文中描述的症状,请及时就医。另外,本文仅节选原文的一部分,内容可能不完整或与原文存在偏差,若需更完整的信息请参阅原文。
参考资料:He et al. The basis and advances in clinical application of boron neutron capture therapy. Radiat Oncol. (2021) 16:216
不感兴趣
看过了
取消

人点赞

人收藏

打赏
不感兴趣
看过了
取消






您已认证成功,可享专属会员优惠,买1年送3个月!
开通会员,资料、课程、直播、报告等海量内容免费看!

打赏金额
认可我就打赏我~
1元 5元 10元 20元 50元 其它
打赏作者
认可我就打赏我~
扫描二维码
立即打赏给Ta吧!
温馨提示:仅支持微信支付!
已收到您的咨询诉求 我们会尽快联系您
