编译:微科盟繁星,编辑:微科盟汤貝、江舜尧。
微科盟原创微文,欢迎转发转载,转载须注明来源《微生态》公众号。
导读
研究发现,益生菌、益生元和富含多酚的干预措施会对空腹血脂指标带来有益的影响。肠道菌群组成的变化在血脂调节中起重要作用。参与脂肪消化和胆固醇代谢的初级胆汁酸可以被肠道菌群转化为次级胆汁酸,其中一些种类的次级胆汁酸重吸收能力较差,因此可能会随粪便排出体外。这会使肝脏合成更多的胆汁酸,进而导致循环低密度脂蛋白的净损失。因此,胆汁酸可能是肠道菌群和心血管健康之间的纽带。本综述概述了胆汁酸代谢以及益生菌、益生元和富含多酚的食物在调节心血管疾病(CVD)风险标志物和胆汁酸中的作用。尽管人体研究的结果并不一致,但越来越多的证据表明这些饮食成分与脂质CVD风险标志物的改善存在关联,这可能与肠道菌群和胆汁酸代谢的调节作用有关。这些调节作用包括由于胆汁螯合作用导致的新合成胆汁酸增加、胆汁盐的代谢活性以及细菌发酵纤维产生的短链脂肪酸。动物研究已证明了FXR/FGF-15轴和肝脏中参与胆汁酸合成(CYP7A1)基因及胆固醇合成(SREBP和HMGR)基因的作用。饮食与胆汁酸代谢之间的关系,以及循环胆汁酸是否可以作为潜在CVD的风险生物标志物需要进一步的人体研究来确定。
原名:Circulating bile acids as a link between the gut microbiota and cardiovascular health: Impact of Prebiotics, probiotics and polyphenol-richfoods
译名:循环胆汁酸是肠道菌群与心血管健康之间的纽带:益生元、益生菌和富含多酚食物的影响
期刊:Nutrition Research Reviews
IF:7.80
发表时间:2021.4.30
通讯作者:Julie A Lovegrove
通讯作者单位:英国雷丁大学食品与营养科学系
3 益生元、益生菌和富含多酚的食物对胆汁酸、肠道菌群和心血管疾病风险的影响
在英国,心血管疾病(Cardiovascular diseases,CVD)是导致死亡和残疾的主要原因。由于饮食和低密度脂蛋白(low density lipoprotein,LDL)-低密度胆固醇(low density lipoprotein-cholesterol,LDL-C)都是重要的CVD风险标志物,因此人们对通过降低LDL-C水平来预防疾病的饮食策略非常感兴趣。据报道,益生菌、益生元和富含多酚的干预措施对空腹血脂指标具有有益的影响,肠道菌群组成的变化在血脂调节中起重要作用。新的研究发现,胆汁酸可能通过影响循环血脂、炎症和血糖来影响肠道菌群和心血管健康,循环胆汁酸的分布和浓度被认为是判定疾病风险的潜在新型生物标志物。胆汁酸在肝脏中由胆固醇合成,是胆汁的主要成分。胆汁酸储存在胆囊中,随食物摄入而释放到肠道中,在肠道中乳化膳食脂肪来促进脂质和脂溶性维生素的吸附。在肠道中,胆汁酸易被细菌产生的酶影响。由某些肠道细菌表达的胆汁盐水解酶(Bile saltHydrolase,BSH)、胆汁酸诱导剂(Bile acid inducible,BAI)和胆汁酸脱水酶可以修饰胆汁酸以生成未结合胆汁酸和次级胆汁酸。这些转化后的胆汁酸在肠道中的吸收性较差,因此,排出的胆汁酸含量可能会受到肠道菌群的影响。绝大多数(95%)胆汁酸通过肝门循环回到肝脏,称为肠肝循环。然而,一小部分会逃脱循环利用并随粪便排出体外。胆汁酸新合成是体内胆固醇调节的有效系统,即从循环中取出胆固醇用于合成新的胆汁酸,从而替代粪便中丢失的胆汁酸。益生菌、益生元和富含多酚的食物已被证明可以改变肠道菌群,可促进具有胆汁酸代谢活性的益生菌生长。由于高水平的循环LDL-C是CVD的重要危险因素,因而益生菌通过影响肠道胆汁酸来降低胆固醇水平可能是益生菌饮食干预降低疾病风险和改善人类健康的关键。本综述将概述胆汁酸代谢,并探讨益生菌、益生元和富含多酚的食物在调节循环胆汁酸和CVD脂质风险标志物中的作用。胆汁酸可通过两种不同的途径合成,即经典途径和替代途径(图1)。有关胆汁酸合成的深入讨论,可阅读Li和Chiang(2014)的评论。在肝脏内,经典的胆汁酸合成在肝细胞中启动,通过胆固醇羟基化实现,这个过程由细胞色素P450酶家族的胆固醇7α-羟化酶(Cholesterol 7α-hydroxylase,CYP7A1)催化。此过程是胆汁酸合成的限速步骤,会使胆固醇转化为7α-羟基胆固醇。法尼醇X受体(Farnesoid X receptor,FXR)可调节CYP7A1的表达,这一过程受到摄入食物后胆汁酸增加这一反馈机制的调节。FXR可以在肝细胞中直接激活或被胃肠道中的胆汁酸激活。在肠道中,FXR的激活会导致成纤维细胞生长因子(Fibroblast growth factor,FGF)19的表达,其进入肝脏中激活FGF受体4(FGFR4)并最终抑制CYP7A1的表达,从而抑制胆汁酸的合成。替代胆汁酸途径发生在线粒体中,主要产生鹅去氧胆酸(Chenodeoxycholic acid,CDCA),因此理论上可以发生在所有细胞和组织类型中。研究发现,替代胆汁酸合成可在大脑、巨噬细胞和肝脏中发生。7α-羟基化氧甾醇在经典和替代胆汁酸途径共有的酶促途径中转化为初级胆汁酸(图1)。在胆汁酸合成的最后一步,胆汁酸通过形成硫酯中间体与氨基酸(甘氨酸或牛磺酸)结合,该中间体由胆汁酸胆酰辅酶A合成酶(Bile acid cholyl-CoA synthetase,BAC)和胆汁酸辅酶A:氨基酸N-酰基转移酶(Bile acid CoA:amino acid N-acyltransferase,BAT)催化。共轭胆汁酸,又称为胆汁盐,具有更强的水溶性,可分泌到储存于胆囊的胆汁中。胆囊收缩素(
Cholecystokinin
,CCK)是胆囊收缩和Oddi括约肌松弛的主要调节剂,有助于在餐后阶段通过胆管和十二指肠乳头向十二指肠释放胆汁。摄入食物后,小肠(十二指肠)感知营养物质(包括脂肪酸和一些氨基酸),使肠内分泌细胞分泌CCK并促进肠道吸收营养物质。 图1 胆汁酸的代谢:在肝脏中,胆固醇可通过经典和替代胆汁酸合成途径在宿主细胞色素P450酶的催化下合成胆汁酸。胆汁酸在肝脏中结合,在胃肠道中被微生物产生的胆盐水解酶(BSH)去结合生成游离初级胆汁酸。游离初级胆汁酸可被微生物进一步修饰,如通过胆汁酸诱导型(BAI)酶脱羟基进而生成多种次级胆汁酸(如脱氧胆酸和石胆酸)。
图1 胆汁酸的代谢:在肝脏中,胆固醇可通过经典和替代胆汁酸合成途径在宿主细胞色素P450酶的催化下合成胆汁酸。胆汁酸在肝脏中结合,在胃肠道中被微生物产生的胆盐水解酶(BSH)去结合生成游离初级胆汁酸。游离初级胆汁酸可被微生物进一步修饰,如通过胆汁酸诱导型(BAI)酶脱羟基进而生成多种次级胆汁酸(如脱氧胆酸和石胆酸)。
甾醇调节元件结合蛋白(Sterol regulatory element-binding proteins,SREBPs)属于碱性螺旋-环螺旋亮氨酸-拉链转录因子家族,受细胞内胆固醇/氧甾醇水平的调节,对脂肪酸和胆固醇合成的调节至关重要。SREBP-1c(由SREBF-1基因产生)主要参与脂肪酸合成,而SREBP-2(由SREBF-2基因编码)参与胆固醇的合成。SREBP-1c表达受胰岛素诱导以及氧甾醇对肝X受体(Liver X receptor,LXR)α的激活,需要生成脂肪酸才可合成胆固醇酯。当氧甾醇水平高时,例如在胆汁酸合成期间,SREBP2的转录因子在内质网膜中作为无活性的前体保留。然而,细胞内氧固醇转化为初级胆汁酸导致SREBP2前体运输到高尔基体,在高尔基体被蛋白酶切割从膜结合前体中释放蛋白质的氨基末端部分。然后这种蛋白质迁移到细胞核,在细胞核激活低密度脂蛋白受体基因的转录,增加肝细胞表面受体的表达,导致细胞内胆固醇水平升高。有趣的是,小鼠研究表明,CYP7A1的过表达会导致SREBP2的肝脏表达增加,表明胆汁酸合成与肝脏胆固醇调节之间存在联系。肠肝循环允许回收从肠道吸收的胆汁酸和其他物质,这些物质被包装为脂质胶束,并通过门静脉血液循环输送回肝脏(图2)。此外,一些游离的疏水胆汁酸通过胃肠道中的被动扩散被重新吸收。一旦进入肝脏,它们就会被分泌到胆汁中,然后重新进入肠道。很大比例(95%)的胆汁酸以这种方式被回收利用,剩下的5%通过粪便排出体外。肝肠循环对于保护胆汁酸池十分重要,而胆汁酸池对肝脏和胃肠道的许多功能至关重要,如胆汁流动、胆固醇的溶解和排泄以及亲脂性化合物的肠道吸收等。此外,这个过程保存了胆固醇和胆汁酸以供重复使用,并避免了甾醇的损失,否则甾醇需要内源性合成或从饮食中获得。 图2 胆固醇和胆汁酸的肠肝循环:肝脏每天需合成0.2-0.6克胆汁酸来维持人体胆汁酸库(含有大约3克胆汁酸)。摄入食物后,营养物质的吸收会刺激胆囊,胆囊会将胆汁酸释放到小肠中。在回肠中,结合胆汁酸可以通过主动转运重吸收,而少量未结合胆汁酸在小肠和大肠中通过被动扩散被重吸收。然后通过肝脏从门静脉血中提取胆汁酸。少量胆汁酸从粪便中排出(约5%),因此肝脏必须新合成胆汁酸作为补充。
图2 胆固醇和胆汁酸的肠肝循环:肝脏每天需合成0.2-0.6克胆汁酸来维持人体胆汁酸库(含有大约3克胆汁酸)。摄入食物后,营养物质的吸收会刺激胆囊,胆囊会将胆汁酸释放到小肠中。在回肠中,结合胆汁酸可以通过主动转运重吸收,而少量未结合胆汁酸在小肠和大肠中通过被动扩散被重吸收。然后通过肝脏从门静脉血中提取胆汁酸。少量胆汁酸从粪便中排出(约5%),因此肝脏必须新合成胆汁酸作为补充。
胃肠道中的微生物会影响初级和次级胆汁酸的比例。这是因为梭状芽孢杆菌(Clostridium)、肠球菌(Enterococcus)、双歧杆菌(Bifidobacterium)、乳杆菌(Lactobacillus)和拟杆菌(Bacteroides)等肠道细菌能够通过7α-脱羟基(BAI编码)酶将初级胆汁酸转化为次级胆汁酸,如石胆酸(LCA)和脱氧胆酸(DCA),并可在回肠远端通过BSH酶进一步转化为未结合形式(表1)。在大肠中,胆汁酸会经历细菌的生物转化(如去结合),然后被代谢(如羟基氧化和二羟基化)。次级胆汁酸,尤其是疏水性更强的胆汁酸,在肠肝循环中吸收性较差,因此更多的胆汁酸可能会从粪便中排出,导致胆固醇的净损失。这是因为细菌的解偶联作用使得胆汁酸因被动扩散吸收能力变差而更加疏水。表1显示了主要胆汁酸的相对疏水性。LCA通常被认为是最疏水的胆汁酸。但是,在文献中找不到非共轭LCA的疏水性指数。同时,结合胆汁酸可以更容易地被IBAT/ABAT转运蛋白吸收。次级胆汁酸占循环胆汁酸的35%,在代谢过程中具有重要的调节功能,包括维持体重和葡萄糖/脂质耐受性。因此,肠道菌群在肠肝循环和胆固醇调节中起着重要作用。

缩写:
FXR
,
farnesoid X receptor
法尼醇
X
受体。
LXRα
,
liver X receptor alpha
肝脏
X
受体
α
。
PXR
,
pregnane X receptor
孕烷
X
受体。
TGR5
,
G protein–coupled bile acid receptor 1 G
蛋白偶联胆汁酸受体
1
。
VDR
,
vitamin D receptor
维生素
D
受体。
在
18
至
45
岁的健康成人中利用
LC-MS/MS
测量空腹血浆中循环胆汁酸的浓度。
疏水性指数
(Hydrophobicity index
,
HI)
为使用反相高效液相色谱
(HPLC)
测量的胆汁盐容量因子的对数,并标准化为牛磺胆酸盐
(HI 0)
和牛磺石胆酸盐
(HI 1)
。肠道菌群的组成与宿主生理之间的联系是通过微生物产生的次级胆汁酸为桥梁的。次级胆汁酸在多个代谢过程中充当关键调节剂,因为与初级胆汁酸相比,次级胆汁酸在激活宿主代谢相关受体方面的能力更强。胆汁酸激活特定的核受体,包括FXR、维生素D受体(Vitamin D receptor,VDR)、孕烷X受体(Pregnane X-receptor,PXR)和G蛋白偶联受体TGR5,这些受体与肝脏和胃肠道的细胞信号通路有关(常见胆汁酸的信号潜力见表1)。FXR的激活与维持正常的甘油三酯(TAG)水平、胆固醇水平和在肝脏和肠道影响CVD风险的调节因素有关,这些因素包括脂质和葡萄糖稳态、内皮功能和动脉粥样硬化。同时,次级胆汁酸LCA和DCA是TGR5的强大配体。这会影响多个重要的代谢途径,例如产热、能量代谢和葡萄糖稳态。TGR5的激活会导致肠道激素-胰高血糖素样肽(Glucagon-like peptide,GLP)-1的产生增加,进而促进胰岛素分泌和食欲调节,并通过将甲状腺激素T4转化为活性形式T3来增加能量消耗。次级胆汁酸在胃肠道和全身的分布可能随着宿主健康状态而变化。例如,在动物模型中,牛磺胆酸盐循环水平随肠道细菌Bilophila wadsworthia的增加而增加,而后者与炎症性肠病有关。DCA是由结肠微生物转化胆酸产生的一种次级胆汁酸。研究发现,肥胖小鼠的血清中DCA浓度更高,这可能是由肠道菌群生态失调导致的,如梭状芽孢杆菌的大量增殖。同时,其他次级胆汁酸的水平可能也与宿主健康有关。例如,已经证明在减肥手术患者中熊去氧胆酸(Ursodeoxycholic acid,UDCA)及其与甘氨酸和牛磺酸结合物的水平增加,同时患者胰岛素敏感性增加。此外,Basso等人对大鼠进行的一项研究发现,部分胃切除术大鼠的UDCA水平升高,这与胰岛素敏感性增强和脂肪分布改变同时发生,而与体重减轻无关。在Roux-en-Y胃绕道术(Roux-en-Y gastric bypass,RYGB)患者中也发现循环胆汁酸水平升高,因为在经过十二指肠和近端空肠时,胆汁酸在到达空肠之前不会与食物混合。这表明更多的胆汁酸被输送到空肠,并且在回肠中IBAT/ABAT转运蛋白对胆汁酸的吸收增加。因此,在门静脉中胆汁酸的浓度增加,更多的胆汁酸被释放到体循环中。此外,减肥手术后肠道菌群会发生改变,厚壁菌门与拟杆菌门的比值(Firmicutes:Bacteroides)有降低的趋势,变形菌门(Proteobacter)有增加的趋势,这一变化可导致BSH活性的增强进而改变肠道胆汁酸池中次级胆汁酸的比例。次级胆汁酸对宿主全身健康的影响已通过直接食用次级胆汁酸或空肠内给药次级胆汁酸得到证实。例如,在健康人类受试者中以颗粒形式摄入UDCA与改善餐后血糖水平和增加GLP-1分泌有关。这种肠道激素可控制葡萄糖诱导的胰岛素排泄和胃排空。此外,研究发现,在大鼠饮用水中添加150 mg/kg的UDCA可以减少果糖诱导的代谢综合征。此外,据报道,空肠内牛磺胆酸(Taurocholic acid,TCA)可降低人体血糖并激活饱腹感激素如GLP-1和YY肽(Peptide YY,PYY)的释放。胆汁酸可以调节影响代谢和脂质分布的各种受体。各种次级胆汁酸充当FXR和TGR5的强或弱兴奋剂,而牛磺-β-鼠胆酸(一种FXR拮抗剂)则会抑制FXR和TGR5的活性。因此,在不同组织中与这些受体接触的循环BA的特征决定了它们的调节水平。这种核受体的激活可能是通过某些肠道细菌的胆汁酸转化功能将菌群组成与心血管健康联系起来的鉴于此,循环胆汁酸可能是代表人类心血管健康的重要生物标志物。3 益生元、益生菌和富含多酚的食物对胆汁酸、肠道菌群和心血管疾病风险的影响
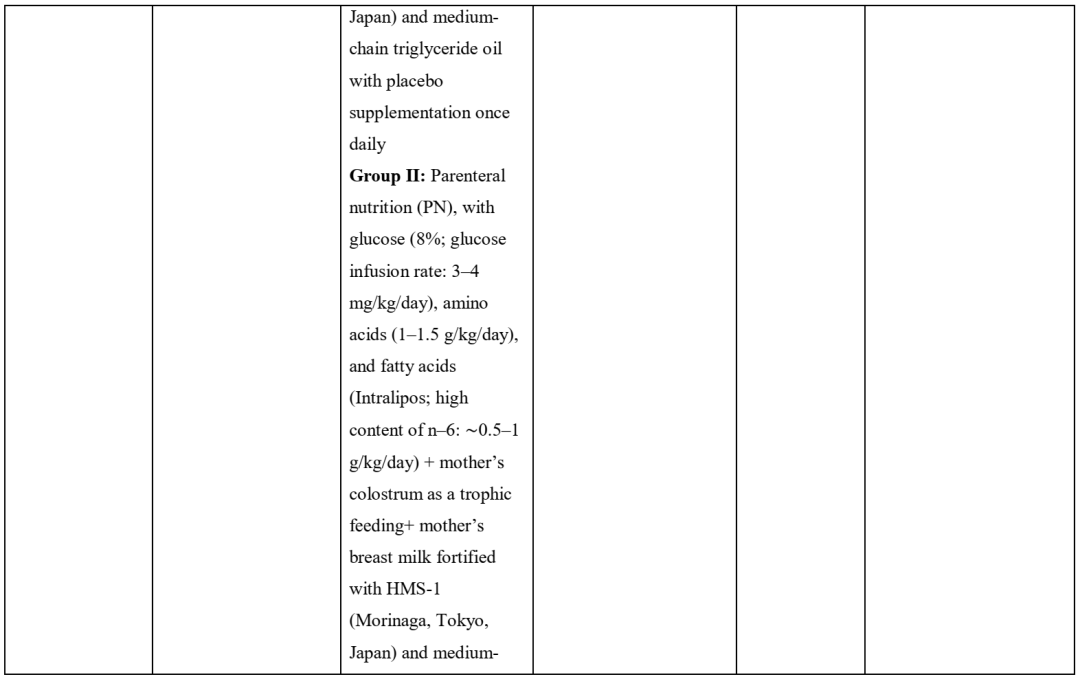
肠道菌群平衡以及胆汁酸稳态的一个重要影响因素是饮食。肠道细菌的分布可通过饮食因素来改变。人体研究表明,水果、蔬菜和纤维摄入量的增加会给人体带来有益的影响,这归因于益生菌、益生元和多酚等成分的存在。在所有主要的肠道细菌中都发现了功能性BSH酶,这种酶具有修饰初级胆汁酸并将其转化为次级胆汁酸的能力。同时,少数肠道细菌具有BAI编码酶,BAI编码酶可将胆汁酸进行7α-脱羟基化并进行进一步的胆汁酸的转化。具有BSH活性的细菌也可通过将牛磺结合胆汁酸转化为未结合胆汁酸来参与控制代谢途径,例如参与葡萄糖和脂质代谢、肠道完整性、炎症和昼夜节律等代谢途径。这已通过小鼠胃肠道中BSH酶的表达得到证实,这导致血浆胆汁酸谱的变化以及脂质代谢基因的转录改变,包括过氧化物酶体增殖物激活受体(PPAR)γ、血管生成素样(ANGPTL)4和肝脏或小肠中的ATP结合盒亚家族G成员(ABCG)5/8(参与胆固醇代谢)。事实上,这些小鼠中BSH表达的增加导致体重增加减少,血浆胆固醇和肝脏甘油三酯水平降低。因此,任何能够影响肠道中具有BSH活性的细菌增殖的膳食成分都可调节胆汁酸稳态并影响宿主心血管健康。据报道,燕麦中的β-葡聚糖和苹果中的果胶等纤维,以及原花青素、儿茶素或单宁等多酚类,都具有胆汁酸螯合能力。这可避免胆汁酸直接进入结肠,因为它们一旦进入结肠便会被排出体外或被结肠细菌转化为次级胆汁酸。研究表明,药物螯合剂可以降低循环LDL-C、减少肥胖、提高胰岛素敏感性并诱导产热。因此,胆汁酸螯合剂具有治疗代谢疾病的潜力。益生元、益生菌和多酚可增加具有胆汁酸代谢活性和胆汁酸螯合能力的肠道细菌的生长,但是关于循环胆汁酸饮食调节是否会对CVD风险标志物产生有益影响仍不清楚。本综述的后半部分将介绍含有益生元、益生菌和多酚的食物通过胆汁酸代谢影响动物和人类相关研究,以解释其对宿主血脂和心血管健康影响的潜在机制。研究涵盖胆汁酸、脂质谱的测定和/或肠道菌群的调节。偏离肠道菌群的自然平衡(即生态失调)与肥胖和炎症性肠病(Inflammatory bowel disease,IBD)等疾病有关。肠道中某些细菌的多样性减少和水平降低会导致粘膜免疫系统的激活,从而导致胃肠道受损,这在IBD中尤为明显。肠道菌群失调还可能导致胆汁酸代谢发生改变,从而通过影响胆汁酸的解偶联、转化和脱硫作用进一步破坏肠道稳态。正常胆汁酸代谢被中断可能会导致肠上皮炎症和肠道通透性增加,使细菌脂多糖易位从而穿过肠-血屏障,进而导致全身炎症。高脂肪饮食常与生态失调和胆汁酸失调有关。这表明胆汁酸作为餐后信号分子的重要性,它可以通过抗菌和抗炎作用影响肠道粘膜防御,减少促炎细胞因子(TNFα、单核细胞和巨噬细胞)的生成。此外,次级胆汁酸合成减少会导致FXR、PXR、TGR5和VDR等核受体活化被抑制。这会使胆汁酸合成发生变化并对脂质稳态产生负面影响。因此,菌群生态失调和由此产生的肠上皮屏障中断与多种疾病有关,如非酒精性脂肪肝(Non-alcoholic fatty liver disease,NAFLD)和心脏代谢疾病。食用益生菌、益生元和富含多酚的食物可以恢复肠道菌群的平衡,调节胆汁酸代谢并恢复核受体的激活。益生菌是有益的细菌菌株,对宿主健康有积极影响。双歧杆菌(Bifidobacterium)和乳杆菌(Lactobacillus)已被鉴定为具有BSH活性的益生菌,其中短双歧杆菌(Bifidobacterium breve)和植物乳杆菌LA3菌株(Lactobacillus plantarum LA3 strains)的BSH活性最高。BSH酶催化共轭初级胆汁酸转化为非共轭胆汁酸的第一步,并进一步将非共轭胆汁酸转化为次级胆汁酸。由于次级胆汁酸吸收性差从而导致肠肝循环中胆汁酸的重吸收减少。某些次级胆汁酸可能更容易从体内排出,胆汁酸新合成和低密度脂蛋白清除率可能会增强。例如,LCA作为最疏水的胆汁酸,在肠肝循环中的重吸收很差,因此粪便中排泄的LCA浓度更高。多项动物研究表明,补充益生菌后循环LDL-C水平降低。人体研究中也得到类似的结果,13项试验的meta-分析结果发现,与对照组相比,使用益生菌干预的人体中总胆固醇(总参与者n=485)的综合平均净变化为-1.66 mmol/L、LDL-C为-1.27 mmol/L、TAG为-0.45 mmol/L。Jones等人发现,在健康的高胆固醇血症男性和女性中,食用罗伊氏乳杆菌(Lactobacillus reuteri)6周后,总胆固醇和LDL-C分别降低了8.9%和4.8%。其中,治疗组(n=56)每天两次食用115克天然酸奶和10克具有BSH活性的罗伊氏乳杆菌(L. reuteri)(相当于1.4×109 CFU)的微胶囊,而安慰剂组(n=58)每天两次食用125克天然酸奶。同样,Costabile等人观察到,在以2×109 CFU(0.1 g)的剂量补充植物乳酸杆菌(Lactobacillus plantarum)12周后,与补充安慰剂(每天两次相同的胶囊形式)的组别相比,健康成人的LDL-C显著降低(降低了13.9%),且总胆固醇也有不显著的降低趋势(降低2%)。同时,Martoni等人发现,在服用延迟释放的益生菌胶囊(Lactobacillus reuteri NCIMB 30242, 3-9×109 CFU,每天两次)4周后,与基线浓度相比,高胆固醇血症成人(n=10)的血清LDL-C降低。已在动物和小范围的人体上开展了相关研究,来进一步了解胆汁酸代谢与响应益生菌摄入的脂质调节之间的联系。在表2和表S1中分别显示了益生菌补充剂对人类(n=4)和动物模型(n=16)胆汁酸的影响。多项动物模型研究发现,各种益生菌菌株的干预可使粪便中胆汁酸的排泄增加。然而,在有限数量的人体试验中,尚未证明长期使用益生菌对胆汁酸排泄有影响。此外,Oshiro等人对妊娠24至31周之间出生的早产儿进行的研究发现,与安慰剂相比,短双歧杆菌(Bifidobacterium breve)补充肠外营养会导致粪便总胆汁酸减少。这些差异使进一步开展人体试验来检验益生菌与胆汁酸的吸收和排泄之间的初步联系成为必要。表2 多酚、益生元和益生菌对人类胆汁酸、脂质谱及肠道菌群影响的研究汇总表。






缩写:
BA
,
bile acid
,胆汁酸。
BSH
,
bile salthydrolysing
,胆盐水解。
BW
,
body weight
,体重。
CO
,
crossover
,交叉。
DB
,
double blind
,双盲。
H
DL-C
,
high density lipo-protein cholesterol
,高密度脂蛋白胆固醇。
HyperChol
,
hypercholesteraemic
,高胆固醇血症。
LDL-C
,
low density lipo-protein cholesterol
,低密度脂蛋白胆固醇。
MS
,
metabolic syndrome
,代谢综合征。
O
,
obese
,肥胖。
OW
,
overweight
,超重。
PCT
,
placebo control trial
,安慰剂对照试验。
RCPI
,
randomised controlled prospective intervention
,随机对照前瞻性干预。
RCT
,
randomised control trial
,随机对照试验。
RGC
,
randomised group comparison
,随机组比较。
SCFA
,
short chainfatty acid
,短链脂肪酸。
TC
,
totalcholesterol
,总胆固醇。
TAG
,
triacylglycerol
,三酰甘油。
VOO
,
virgin oliveoil
,初榨橄榄油。

图1 胆汁酸的代谢:在肝脏中,胆固醇可通过经典和替代胆汁酸合成途径在宿主细胞色素P450酶的催化下合成胆汁酸。胆汁酸在肝脏中结合,在胃肠道中被微生物产生的胆盐水解酶(BSH)去结合生成游离初级胆汁酸。游离初级胆汁酸可被微生物进一步修饰,如通过胆汁酸诱导型(BAI)酶脱羟基进而生成多种次级胆汁酸(如脱氧胆酸和石胆酸)。
图2 胆固醇和胆汁酸的肠肝循环:肝脏每天需合成0.2-0.6克胆汁酸来维持人体胆汁酸库(含有大约3克胆汁酸)。摄入食物后,营养物质的吸收会刺激胆囊,胆囊会将胆汁酸释放到小肠中。在回肠中,结合胆汁酸可以通过主动转运重吸收,而少量未结合胆汁酸在小肠和大肠中通过被动扩散被重吸收。然后通过肝脏从门静脉血中提取胆汁酸。少量胆汁酸从粪便中排出(约5%),因此肝脏必须新合成胆汁酸作为补充。











