编译:微科盟书明,编辑:微科盟汤貝、江舜尧。
微科盟原创微文,欢迎转发转载,转载须注明来源《微生态》公众号。
导读
益生菌在减轻胃肠道炎症和预防结直肠癌方面的有益作用已有报道,但益生菌在抑制肠外肿瘤进展方面的免疫调节作用机制尚不清楚。这项研究表明,益生菌补充剂可减轻小鼠黑色素瘤细胞的肺转移。用VSL#3益生菌喂养小鼠会改变肠道微生物群的组成和比例。肠道细菌组成的变化,例如毛螺菌科、链球菌和Lachnoclostridium的丰度变化,与肠道中短链脂肪酸的产生有关。喂食VSL#3后,肠道和血液中丙酸和丁酸的浓度上调,丙酸和丁酸水平的增加促进了肺内皮细胞趋化因子配体20(CCL20)的表达,并通过CCL20/趋化因子受体6促进T辅助细胞17(Th17)募集进入肺部。Th17细胞的募集减少了肺中肿瘤病灶的数量,并减弱了小鼠黑色素瘤细胞的肺转移。研究结果提供了关于益生菌在减轻肠外肿瘤转移中的作用和作用机制的新信息。
原名:Propionate and Butyrate Produced by Gut Microbiota after Probiotic Supplementation Attenuate Lung Metastasis of Melanoma Cells in Mice
译名:补充益生菌后肠道微生物群产生的丙酸盐和丁酸盐减轻小鼠黑色素瘤细胞的肺转移
期刊:Molecular Nutrition and Food Research
IF:5.914
发表时间:2021.6.1
通讯作者:曾宪录&可月双
通讯作者单位:东北师范大学遗传与细胞研究所分子表观遗传学教育部重点实验室

1 喂养益生菌(VSL#3)可显著减轻小鼠黑色素瘤细胞的肺转移VSL#3是一种包含八种细菌菌株的产品,这些菌株已在基因组水平上进行了表征。在本实验中,VSL#3用于探索益生菌对肠外肿瘤进展的免疫调节作用和作用机制。B16F10是一种黑色素瘤细胞系,具有较高的向肺部转移的能力。B16F10的肺部转移模型模型可用来检查肺转移灶的形成。TB(荷瘤)组小鼠静脉注射1
×
105 B16F10细胞,不进行VSL#3治疗。在VSL#3治疗组中,小鼠以2×108CFU/天(VSL#3高剂量)或2×107CFU/天(VSL#3低剂量)灌胃VSL#3,然后按文献剂量给小鼠注射B16F10细胞。在B16F10注射后第18天,处死小鼠并暴露肺组织以计算肿瘤病灶数。形态学和组织病理学(H&E)检查结果显示,与TB小鼠相比,两种剂量的VSL#3治疗都减少了肺中肿瘤病灶的数量(图1A、B)。此外,
VSL#3
处理后小鼠的体重没有显著差异(图1C)。注射B16F10后,TB组小鼠的存活时间为22.87天,而VSL#3低剂量组小鼠的存活时间为24.25天,VSL#3高剂量组小鼠的存活时间为25.75天(图1D)。这些结果表明用VSL#3喂养小鼠减弱了黑色素瘤细胞的肺转移,延长存活时间。
图1. 喂养益生菌(VSL#3)显著减弱小鼠黑色素瘤细胞的肺转移。C57BL/6小鼠灌胃益生菌剂VSL#3低剂量2×107CFU/天,高剂量2×108CFU/天,然后静脉注射B16F10细胞(1×105个/只)注射B16F10后第18天,对肺组织进行分析。A) 肺表面和HE染色切片中的肿瘤病灶情况。B) 计数肺表面上大于1mm的肿瘤病灶的数量,并在治疗组之间进行比较。N=6。C) 每2天测量一次各治疗组小鼠的体重。D) B16F10注射和VSL#3喂养后小鼠的存活时间。N=10,数据是平均值±标准误;与TB组相比,*p<0.05,**p<0.01。
2 VSL#3改变肠道微生物群的组成并增加产SCFA的菌群数量肠道微生物群稳态失衡或“生态失调”可能是导致多种疾病的诱因(包括癌症)。据报道,益生菌可以调节肠道菌群的组成和宿主的免疫反应,参与肿瘤过程。为了确定与黑色素瘤细胞肺转移相关的细菌种类,使用16S rRNA测定分析TB组小鼠和VSL#3治疗组小鼠肠道菌群组成。因在减轻肺部转移中VSL#3高剂量组效果更好,所以后续使用高剂量治疗小鼠。首先,UPGM分析结果显示,对照、TB和TB+VSL#3组三个样本聚集在一起,表明本实验中各组肠道微生物群的物种组成相似且稳定。同时,与TB组相比,对照组和TB+VSL#3组的簇分支更短,表明这两个组的细菌种类组成更为相似(图2A)。然后,我们评估了样本α多样性指数,并使用Shannon指数、Simpson’s指数、Chao1和ACE作为物种丰富度和多样性的指标。结果表明,VSL#3喂养不影响OTU数量和α多样性,表明VSL#3治疗不会改变物种丰富度和多样性(图2B)。此外,VSL#3导致菌群整体组成发生变化,但未观察到新菌株(图2C,左)。物种分布的直方图显示,与TB组小鼠相比,经VSL#3治疗的小鼠在门水平上具有高频率的厚壁菌门比例(平均42% vs 61%)和低频率的拟杆菌门比例(平均50% vs30%),并且TVSL#3治疗小鼠的微生物组组成与对照小鼠更相似(图2C,右)。当在属水平上比较治疗组的每个肠道微生物群分类谱时,我们发现与TB组小鼠相比,VSL#3治疗的小鼠中,毛螺菌科、链球菌和Lachnoclostridium显著增加(图2D)。之前有报道称这些细菌是SCFA生产者。总的来说,这些结果表明用VSL#3喂养小鼠会增加产SCFA细菌的数量。
图2. VSL#3处理改变了肠道微生物群的组成并增加了产SCFA的菌群的数量。使用16S rRNA分析各组的肠道菌群组成。A)来自对照、TB和TB+VSL#3组的三个样品的UPGMA分析。B)确定每组的OTU数、α样性、Shannon指数、Simpson’s指数、Chao1ACE指数。C、D)在门和属水平上分析每组肠道微生物群中的物种分布直方图。N=3,数据是平均值±标准误;与TB组相比,*p < 0.05,**p < 0.01。
3 丙酸盐和丁酸盐是与抑制肺部黑色素瘤转移相关的主要SCFAs先前的研究表明,属于毛螺菌科、链球菌和
Lachnoclostridium
的细菌是SCFA的生产者,其中乙酸盐、丙酸盐和丁酸盐是主要的SCFAs。我们使用GC/MS分析了第7天和第14天使用VSL#3处理后小鼠肠道和血清中SCFA的浓度。在VSL#3治疗后,小鼠肠道和血液中乙酸盐,丙酸盐,丁酸盐含量明显增加(图3A,B)。为了探索SCFAs水平是否与抑制黑色素瘤细胞肺转移有关,雄性C57BL/6小鼠(6-8周)在静脉注射1×105 B16F10细胞后,注射醋酸盐(30 mg/mL)、丙酸盐(15 mg/mL)或丁酸盐(8.8 mg/mL),每周三次。在B16F10注射后第18天,处死小鼠,暴露肺组织以计算病灶数。形态学和组织病理学(H&E)检查结果显示,丙酸和丁酸处理后肿瘤病灶减少,但乙酸盐处理后并未减少(图3C、D)。以往的研究报道称,SCFAs抑制肿瘤细胞增殖并直接促进肿瘤细胞凋亡。为检测乙酸盐、丙酸盐和丁酸盐对黑色素瘤细胞增殖和凋亡的影响,采用
CCK-8
实验和
Annexin V-APC/PI
染色分析不同浓度乙酸盐、丙酸盐和丁酸盐对B16F10细胞增殖和凋亡的影响。结果显示乙酸盐、丙酸盐和丁酸盐不直接影响B16F10细胞的增殖和凋亡(图S1A-G)。这些结果表明丙酸和丁酸是与黑色素瘤细胞转移减弱相关的主要SCFA,但这些SCFA不直接影响B16F10细胞增殖和凋亡。
图3. 丙酸盐和丁酸盐是与抑制肺部黑色素瘤转移相关的主要短链脂肪酸。A) 第7天,TB和VSL#3处理的小鼠肠道和血清中乙酸盐、丙酸盐和丁酸盐的平均浓度。B) 第14天,TB和TB+VSL#3处理的小鼠肠道和血清中醋乙酸盐、丙酸盐和丁酸盐的平均浓度。C) 给小鼠注射B16F10黑色素瘤细胞18天,然后TB组小鼠:不治疗,其他各组分别用乙酸盐、丙酸盐或丁酸盐治疗。上图:小鼠肺表面大于1 mm的肿瘤病灶,在照片中可见为黑点,对每个治疗组进行计数。下图:TB小鼠和用乙酸盐、丙酸盐或丁酸盐治疗的小鼠肺部H&E染色切片。D) 在治疗组之间比较肺表面上大于1 mm的肿瘤病灶的数量。N=6,数据是平均值±标准误;与TB组相比,*p < 0.05,NS表示无意义。4 丙酸盐和丁酸盐促进肺Th17细胞的募集和CCL20表达之前的研究报告称,益生菌及其代谢物通过增加免疫细胞的数量/活性,以及促进效应T细胞浸润到肿瘤中来发挥全身作用。使用流式细胞术分析了TB组和丙酸盐或丁酸盐治疗组小鼠转移性肺微环境中的主要效应细胞。结果显示,各组肺中CD8+ T细胞的百分比无显著差异(图4A,图S2A),而丙酸盐或丁酸盐处理后CD4+ T细胞的百分比增加(图4B,图S2B)。我们进一步分析了CD4+ T细胞亚群,发现调节性T(Treg)细胞(图4C,图S2C,)和Th1细胞没有差异(图4D,图S2D),而Th17细胞在丙酸盐或丁酸盐处理的小鼠肺中显著增加(图4E,图S2E)。以前的研究报道称,趋化因子受体6(CCR6)在Th17细胞上的表达可以被鉴定为迁移型,而CCL20是CCR6的特异性配体。在我们的实验中,使用流式细胞术分析肺中的CCR6+ Th17细胞,结果表明,与TB小鼠相比,丙酸盐或丁酸盐处理的小鼠中CCR6+ Th17细胞的百分比增加(图4F,图S2F)。CCL20 mRNA的相对表达在肺组织中明显上调,蛋白质水平也呈现了类似的结果(图4G、H)。结果表明丙酸盐和丁酸盐促进肺Th17细胞的募集。我们还检测了CCL20在肝脏和肾脏中的表达,结果表明CCL20 mRNA的相对表达仅在肺中上调(图S3)。
图4. 丙酸盐和丁酸盐促进肺中Th17细胞的募集和CCL20的表达。收集并消化各组肺组织,制备单细胞用于流式细胞术。(A) CD8+ T、(B) CD4+ T、(C) Treg、(D) Th1、(E) Th17和(F) CCR6+ Th17细胞在肺组织中的频率分布。G) CCL20 mRNA在肺组织中的相对表达。H)肺中CCL20表达的蛋白质印迹分析和条带的相对强度量化。N=6,数据是均值±标准误;与TB组相比,*p < 0.05和**p < 0.01。5 肺内皮细胞中CCL20表达促进Th17细胞招募至肺部以上结果表明丙酸盐和丁酸盐处理促进了肺中Th17细胞的募集和CCL20的表达。以前的研究报告说,肺中的几种类型的细胞可以分泌CCL20,例如内皮细胞、上皮细胞、巨噬细胞、和肿瘤细胞。为了研究哪种类型的细胞分泌CCL20,使用了内皮细胞系MS1、上皮细胞系MLE12、巨噬细胞系Raw264.7和
B16F10
肿瘤细胞。当存在丙酸盐或丁酸盐的情况下,MS1细胞的CCL20mRNA表达量明显增加,但是与对照组相比,MLE12、Raw264.7、B16F10则没有明显改变(图5A)。收集细胞上清液后,使用ELISA分析上述细胞分泌的CCL20的蛋白质水平。结果表明,MS1细胞分泌的CCL20蛋白在受到丙酸盐或丁酸盐刺激后也有所增加(图5B)。此外,
transwell
分析表明,与阴性对照相比,在丙酸盐或丁酸盐存在下,Th17细胞迁移的频率显著增加,CCL20作为阳性对照(图5C)。为了进一步确认肺内皮细胞是否是CCL20的主要来源,我们分离了有或没有白细胞和内皮细胞的肺,以分析CCL20的表达水平(图S4A、B)。我们观察到没有白细胞的肺中CCL20的表达高于有白细胞的肺(图S4A),并且有内皮细胞的肺中CCL20的表达高于没有内皮细胞的肺(图S4B)。此外,在mRNA(图5D)和蛋白质(图5E)水平上,丙酸盐或丁酸盐处理的TB小鼠的内皮细胞中CCL20的表达远高于未处理的TB小鼠。这些结果表明肺内皮细胞可以分泌CCL20来募集Th17。为了进一步证实内皮细胞分泌的CCL20负责在肺中募集Th17细胞,如前所述,基于慢病毒的RNA干扰对CCL20进行了每周三次胸膜内注射。通过CCL20表达评估每个序列的干扰效率。结果表明,sh1CCL20或sh2CCL20慢病毒注射后,肺组织中CCL20的mRNA相对表达和蛋白水平与shctrl相比显著降低(图5F、G)。流式细胞术结果显示,注射shCCL20慢病毒后肺中Th17细胞的百分比显著降低(图5H)。这些结果表明,在肺内皮细胞中表达的CCL20是Th17向肺募集的主要贡献者。 图5. 在肺内皮细胞中表达的CCL20是Th17细胞向肺募集的主要贡献者。A)MS1、MLE12、Raw264.7和B16F10细胞系在丙酸盐(40 μM)或丁酸盐(20 μM)存在下孵育24h,mRNA相对表达被检测。B) 收集(A)的细胞上清液并使用ELISA测量CCL20。C) 进行Transwell测定以显示在丙酸盐或丁酸盐存在下迁移的Th17细胞的数量,并使用CCL20(5 ng/mL)作为阳性对照。D) 收集分离的肺内皮细胞,实时荧光定量PCR检测各组CCL20 mRNA的相对表达量。E) 提取分离的肺内皮细胞的总蛋白并使用蛋白质印迹检查CCL20表达(左),并定量条带的相对强度(右)。F) shCCL20慢病毒在mRNA水平上的干扰效率。G)shCCL20慢病毒在蛋白质水平上的干扰效率。H)注射B16F10细胞后第18天小鼠注射shCCL20慢病毒后肺中Th17细胞的频率分布。N=6,数据是平均值±标准误,NS表示没有意义,*p<0.05和**p<0.01代表统计显著性。
图5. 在肺内皮细胞中表达的CCL20是Th17细胞向肺募集的主要贡献者。A)MS1、MLE12、Raw264.7和B16F10细胞系在丙酸盐(40 μM)或丁酸盐(20 μM)存在下孵育24h,mRNA相对表达被检测。B) 收集(A)的细胞上清液并使用ELISA测量CCL20。C) 进行Transwell测定以显示在丙酸盐或丁酸盐存在下迁移的Th17细胞的数量,并使用CCL20(5 ng/mL)作为阳性对照。D) 收集分离的肺内皮细胞,实时荧光定量PCR检测各组CCL20 mRNA的相对表达量。E) 提取分离的肺内皮细胞的总蛋白并使用蛋白质印迹检查CCL20表达(左),并定量条带的相对强度(右)。F) shCCL20慢病毒在mRNA水平上的干扰效率。G)shCCL20慢病毒在蛋白质水平上的干扰效率。H)注射B16F10细胞后第18天小鼠注射shCCL20慢病毒后肺中Th17细胞的频率分布。N=6,数据是平均值±标准误,NS表示没有意义,*p<0.05和**p<0.01代表统计显著性。
上述实验表明,当CCL20被慢病毒注射敲除时,肺中Th17细胞的百分比下降。我们进一步表明,在注射shCCL20后,与丙酸盐或丁酸盐处理的小鼠相比,肿瘤病灶的数量增加(图6A、B)。这些结果表明,肺中Th17细胞的募集可能是抑制黑色素瘤细胞肺转移的原因。为了证实Th17细胞在肺转移中的功能,根据先前的研究,将初始CD4+ T细胞从脾脏中分离出来并用于体外诱导Th17细胞,分化率约为15.3%(图6C)。如图6D所示,将诱导的细胞通过静脉注射(每只小鼠6×105个细胞)转移到小鼠体内。过继的Th17细胞用PKH26染色,FITC用于使用流式细胞术检测过继的Th17细胞的转移效率(图S5)。在B16F10细胞注射后第18天,对肺中的肿瘤病灶进行计数。形态学和组织病理学检查显示Th17细胞转移导致肺中肿瘤病灶数量减少(图6E、F)。这些数据表明,肺中Th17细胞数量的增加在抑制小鼠黑色素瘤细胞肺转移中起关键作用。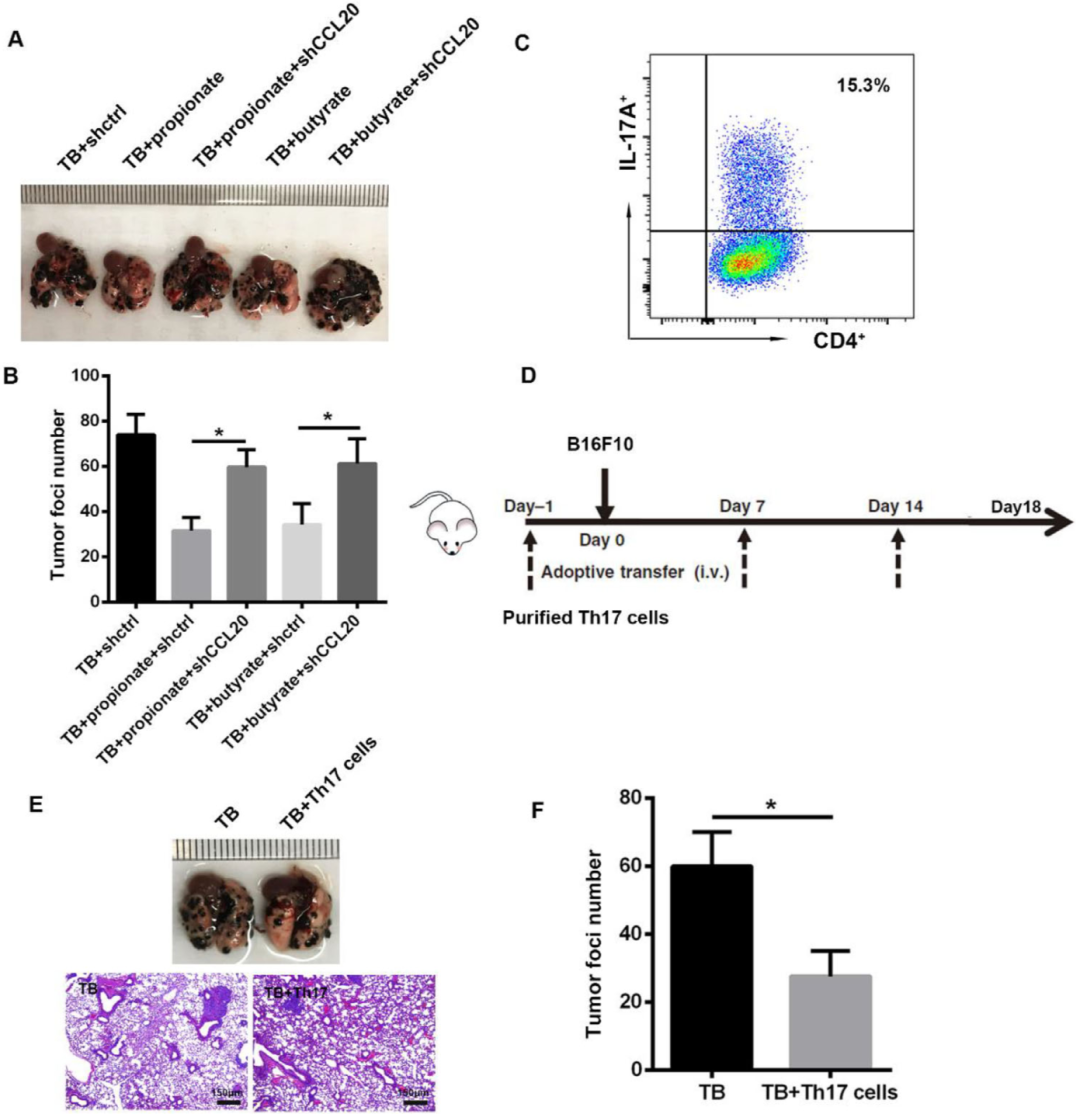 图6. Th17细胞抑制小鼠黑色素瘤细胞肺转移。A) TB小鼠注射shCCL20慢病毒后肺表面的肿瘤病灶。B) 计算肺表面肿瘤灶的数量。N=6,数据表示为平均值±标准误;与TB+丙酸盐+shctrl和TB+丁酸盐+shctrl各自比较,*p<0.05。C) 流式细胞仪测定Th17细胞分化率。D) 小鼠Th17细胞转移和B16F10细胞注射示意图。在B16F10注射前1天静脉内转移Th17细胞(每只小鼠6×105个细胞),然后每7天再转移一次,直到18天。在B16F10注射前1天静脉内转移Th17细胞(每只小鼠6×105个细胞),然后每7天再转移一次,直到18天。E) B16F10注射和Th17转移18天后肺组织表面和H&E染色切片中的肿瘤病灶。F) 计算肺上肿瘤病灶的总数。N=6,数据是平均值±标准误;与TB组比较,*p<0.05。
图6. Th17细胞抑制小鼠黑色素瘤细胞肺转移。A) TB小鼠注射shCCL20慢病毒后肺表面的肿瘤病灶。B) 计算肺表面肿瘤灶的数量。N=6,数据表示为平均值±标准误;与TB+丙酸盐+shctrl和TB+丁酸盐+shctrl各自比较,*p<0.05。C) 流式细胞仪测定Th17细胞分化率。D) 小鼠Th17细胞转移和B16F10细胞注射示意图。在B16F10注射前1天静脉内转移Th17细胞(每只小鼠6×105个细胞),然后每7天再转移一次,直到18天。在B16F10注射前1天静脉内转移Th17细胞(每只小鼠6×105个细胞),然后每7天再转移一次,直到18天。E) B16F10注射和Th17转移18天后肺组织表面和H&E染色切片中的肿瘤病灶。F) 计算肺上肿瘤病灶的总数。N=6,数据是平均值±标准误;与TB组比较,*p<0.05。
越来越多的证据表明肠道微生物群会影响癌症过程。益生菌,尤其是乳杆菌和双歧杆菌属,可用作癌症预防或癌症治疗的佐剂,因为它们具有调节肠道微生物群组成和宿主免疫反应的能力。大多数研究都集中在肠癌上,而一些研究报告称,益生菌在预防肠外癌方面发挥着积极作用。然而,益生菌及其代谢物是否在肺部肿瘤细胞转移中发挥作用仍不清楚。在本研究中,我们发现VSL#3(一种益生菌混合物)通过调节Th17细胞向肺部的募集来减弱黑色素瘤细胞的肺转移。SCFAs是肠道微生物群降解膳食纤维产生的重要代谢物,乙酸盐、丙酸盐和丁酸盐是主要的SCFAs。SCFAs被吸收并以低但可测量的浓度进入体循环。SCFAs也可以在痰液中检测到(0.1-5 mM),表明它们可以到达肺部和气道。在本研究中,小鼠经VSL#3处理后,肠道中毛螺菌科、链球菌和Lachnoclostridium的相对丰度均增加,这些细菌都是已知的参与短链脂肪酸产生的有益细菌。我们发现VSL#3治疗增加了小鼠肠道和血液中乙酸盐、丙酸盐和丁酸盐的浓度,并且丙酸盐和丁酸盐水平的升高与小鼠肺部黑色素瘤细胞转移的减少有关,这表明丙酸盐和丁酸盐可能在抑制肿瘤转移中起重要作用。先前的一项研究报道,SCFAs在高浓度下会影响结肠癌细胞系的肿瘤细胞增殖和凋亡。在这里,我们的研究表明乙酸盐、丙酸盐和丁酸盐对血液中一定浓度的B16F10细胞没有影响。造成这一结果的可能原因是肠道中SCFAs的浓度高于血液中的浓度,高浓度的SCFAs具有影响肿瘤细胞增殖和凋亡的能力。因此,我们的研究有助于进一步了解黑色素瘤细胞转移的调控。Th17细胞在肿瘤中的作用是矛盾的和有争议的。例如,据报道,Th17细胞可以通过诱导其他免疫细胞(包括CTL、NK细胞和中性粒细胞)的募集来发挥其抗肿瘤功能。然而,也有报道称Th17细胞通过增加肿瘤组织中Treg细胞的浸润和促进M2巨噬细胞分化以促进肿瘤生长、增殖和转移而发挥致瘤功能。此外,Th17细胞在不同类型肿瘤中的作用和作用机制是多种多样的。在我们的实验中,在用VSL#3喂养小鼠或注射丙酸盐和丁酸盐后,Th17细胞被募集到转移性肺,结果,肿瘤病灶的数量减少。该结果通过小鼠中的Th17转移测定进一步证实。因此,我们的结果表明,将Th17细胞募集到肺部对黑色素瘤细胞的转移具有抗肿瘤作用。据报道,Th17细胞通过CCR6/CCL20轴迁移到肿瘤。在我们的实验中,我们发现在丙酸盐和丁酸盐存在的情况下,肺中CCL20的表达显著增加,并且肺中CCL20表达的增加是Th17细胞募集的原因。虽然在肺部一些类型的细胞都能分泌CCL20,比如内皮细胞、上皮细胞、巨噬细胞和肿瘤细胞,但我们发现内皮细胞是CCL20产生的主要贡献者。一些其他组织,如肝脏和肾脏,也表达了CCL20,但相同条件下表达没有增加。因此,我们提供了关于调节荷瘤小鼠肺部Th17细胞募集的新信息。总之,我们目前的研究报告了SCFAs在益生菌治疗后肿瘤转移中的作用。基于这些数据,我们提出了以下模型。在荷瘤小鼠中,补充VSL#3增加了肠道中产生SCFA的细菌数量。血液中丙酸盐和丁酸盐的浓度上调,促进了肺内皮细胞中CCL20的表达。Th17细胞通过CCL20/CCR6轴被募集到肺部并减弱了黑色素瘤细胞的转移。因此,我们的研究结果为益生菌在减轻肠外肿瘤转移中的作用提供了证据。

图5. 在肺内皮细胞中表达的CCL20是Th17细胞向肺募集的主要贡献者。A)MS1、MLE12、Raw264.7和B16F10细胞系在丙酸盐(40 μM)或丁酸盐(20 μM)存在下孵育24h,mRNA相对表达被检测。B) 收集(A)的细胞上清液并使用ELISA测量CCL20。C) 进行Transwell测定以显示在丙酸盐或丁酸盐存在下迁移的Th17细胞的数量,并使用CCL20(5 ng/mL)作为阳性对照。D) 收集分离的肺内皮细胞,实时荧光定量PCR检测各组CCL20 mRNA的相对表达量。E) 提取分离的肺内皮细胞的总蛋白并使用蛋白质印迹检查CCL20表达(左),并定量条带的相对强度(右)。F) shCCL20慢病毒在mRNA水平上的干扰效率。G)shCCL20慢病毒在蛋白质水平上的干扰效率。H)注射B16F10细胞后第18天小鼠注射shCCL20慢病毒后肺中Th17细胞的频率分布。N=6,数据是平均值±标准误,NS表示没有意义,*p<0.05和**p<0.01代表统计显著性。
图6. Th17细胞抑制小鼠黑色素瘤细胞肺转移。A) TB小鼠注射shCCL20慢病毒后肺表面的肿瘤病灶。B) 计算肺表面肿瘤灶的数量。N=6,数据表示为平均值±标准误;与TB+丙酸盐+shctrl和TB+丁酸盐+shctrl各自比较,*p<0.05。C) 流式细胞仪测定Th17细胞分化率。D) 小鼠Th17细胞转移和B16F10细胞注射示意图。在B16F10注射前1天静脉内转移Th17细胞(每只小鼠6×105个细胞),然后每7天再转移一次,直到18天。在B16F10注射前1天静脉内转移Th17细胞(每只小鼠6×105个细胞),然后每7天再转移一次,直到18天。E) B16F10注射和Th17转移18天后肺组织表面和H&E染色切片中的肿瘤病灶。F) 计算肺上肿瘤病灶的总数。N=6,数据是平均值±标准误;与TB组比较,*p<0.05。











