编译:微科盟莫扎她一,编辑:微科盟木木夕、江舜尧。
微科盟原创微文,欢迎转发转载,转载须注明来源《微生态》公众号。
导读
【背景和目标】喀斯特石漠化(KRD)影响土壤特性和植物种类。土壤微生物是维持生态系统稳定的重要因素。然而,关于真菌在植物适应KRD中的作用知之甚少。
【方法】通过ITS2扩增子测序分析了在强和轻度KRD下在非根际、根际和Themeda japonica根系中定殖的真菌。通过冗余分析(RDA)和Spearman分析估计土壤养分与真菌多样性之间的关系。
【结果】强KRD土壤的AN、NN、SOC、TN、TP含量和pH值高于轻度KRD土壤。轻度KRD的根际真菌丰富度和多样性高于强KRD的根际,但KRD程度之间的根内生菌没有差异。与强KRD相比,具有轻度KRD的非根际土壤具有更高的真菌丰富度。不同KRD程度植物间的非根际土壤、根际和根系的真菌群落存在显著差异。此外,根际真菌群落对KRD环境的变化较敏感。在强和轻度KRD下,子囊菌门和担子菌门是非根际土壤、根际和根系内生菌中的优势门。SOC、AN和pH在强KRD下影响真菌群落的组成。相比之下,TN和AN对丰富度有消极影响。
【结论】我们的研究结果表明,根际真菌群落可能在T. japonica对KRD的适应中发挥作用,并可能有助于促进喀斯特地区的植物生长和生态性能。
原名:Structural variability in the bulk soil,rhizosphere,and root endophyte fungal communities of Themeda japonica plants under different gradesof karst rocky desertification
译名:不同喀斯特石漠化程度下黄背草非根际、根际和根系内生真菌群落的结构变异
期刊:Plant Soil
IF:4.192
发表时间:2021.5.7
通讯作者:乙引
通讯作者单位:贵州师范大学

我们发现SOC含量(P<0.001)、TN含量(P<0.001)、TP含量(P=0.010)、NN含量(P=0.002)、AN含量(P<0.001)和pH值(P=0.004)在具有强KRD的样点中显著高于具有轻度KRD的样点。轻度KRD和强KRD之间的AP含量没有显著差异(P=0.081)(图1)。SOC和NN含量受KRD程度影响最大,在具有强KRD的地点分别高60%和28200%。在具有强KRD的样点中,AN、TN和TP含量分别高出177%、165%和63%。此外,具有强KRD的pH值高7.2%。

图1. 不同程度KRD对土壤养分含量的影响。(a)SOC,(b)TN,(c)TP,(d)NN,(e)AN,(f)AP,(g)pH。**和***分别表示强KRD和轻度KRD(独立t检验)之间P<0.01和P<0.001的显著差异。
在去除模糊的、短的和低质量的读数和单例OTU后,从30个可用于群落分析的样本中获得了3973个独特的真菌OTU。我们发现不同程度KRD(DGK)(P=0.003)和不同地点(DS)(P<0.001)之间真菌群落的丰富度和Shannon多样性指数存在显著差异(P<0.001)(表1)。此外,我们发现DGK×DS的交互作用显著影响了丰富度(P=0.009)(表1)。与强KRD相比,具有轻度KRD的地点的非根际土壤和根际样本中的真菌丰富度更高(图2a)。相比之下,当比较不同的KRD程度时,根内生菌群落之间的丰富度和Shannon多样性没有差异(图2a、b)。根际真菌群落的Shannon多样性在轻度KRD的地点与强KRD的地点相比略高,但KRD程度对非根际土壤和根内生菌群落的多样性没有影响(图2b)。此外,在轻度和强KRD下,真菌丰富度和Shannon多样性在不同地点(非根际土壤、根际、根样本)之间分别存在显著差异(图2a、b)。
表1. 不同程度KRD(DGK)和不同样点(DS)对丰富度和Shannon多样性影响的双因素方差分析结果。
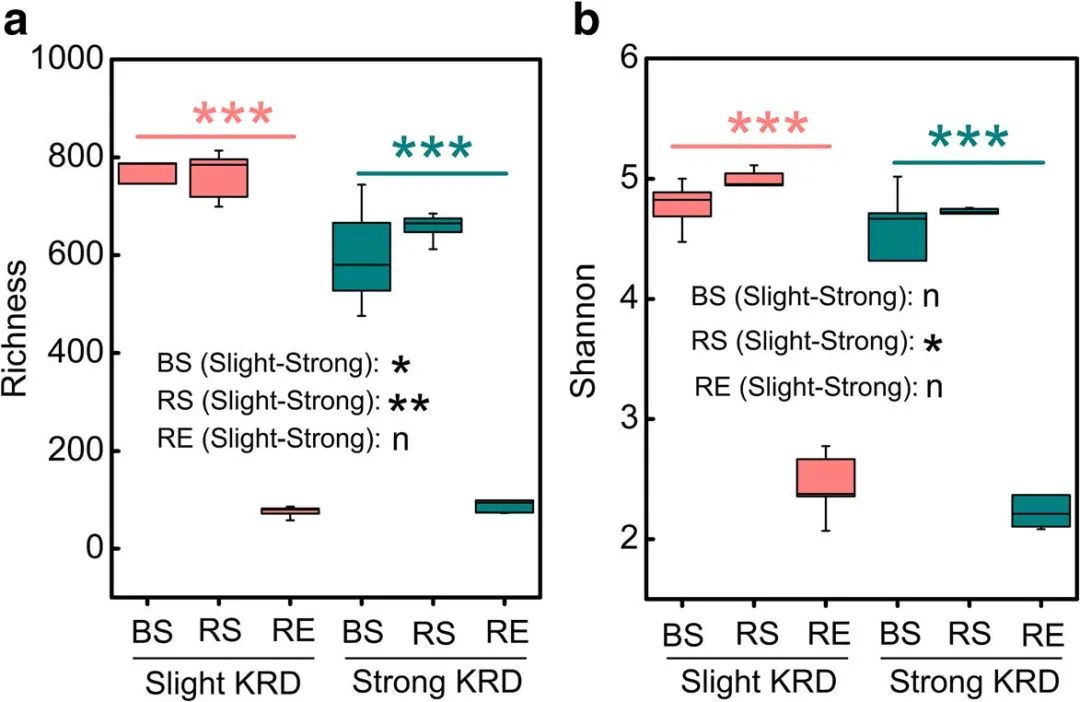
图2. 不同程度的KRD对非根际土壤、根际和根内生菌中真菌群落丰富度和Shannon多样性的影响,(a)丰富度,(b)Shannon多样性。***粉红色线和绿色线上方的*** 分别在轻度KRD和强KRD(方差分析)中表示非根际土壤、根际和根内生菌之间P<0.001的差异显著;BS/RS/RE(强-轻)后的*和**分别表示强KRD和轻度KRD在非根际土壤、根际和根内生菌中P <0.05和P <0.01的显著差异(独立t-检验),n分别表示在非根际土壤、根际和根内生菌中强KRD和轻度KRD之间的差异没有统计学意义(独立t检验)。BS:非根际土壤,RS:根际土壤,RE:根内生菌。
3 KRD程度和采样地点在门和属水平上影响真菌群落组成在我们分析的所有群落中,无论采样位置或KRD程度如何,真菌门子囊菌门和担子菌门的成员占主导地位,尽管后者门在具有强KRD的地点不那么占优势(图3)。此外,我们从两个KRD程度中确定了非根际土壤和根际群落中的真菌门Glomeromycota和Mortierellomycota的成员,但在根内生菌群落中没有。此外,我们发现壶菌门的成员存在强KRD的土壤和根际群落中,但在我们分析的所有其他群落中都不存在(图3)。子囊菌门(67.3%)、担子菌门(26.3%)、球囊菌门(2.6%)和被孢霉门(2.0%)是主要的真菌门,在轻度KRD的非根际土壤中相对丰度超过1%;同样,相对丰度大于1%的优势真菌门是子囊菌门(80.0%)、担子菌门(12.9%)、球囊菌门(1.8%)和被孢霉门(Mortierellomycota)(2.4%)在轻度KRD下;相对丰度大于1%的优势真菌门为子囊菌门(65.7%)和担子菌门(33.5%),在轻度KRD下根内生真菌。重要的是,在轻度的KRD下,在根内生真菌中未发现被孢霉属(图3a)。子囊菌和担子菌在非根际土壤、根际土壤和根中的内生真菌中含量更高。此外,在强KRD下的非根际土壤中,相对丰度大于1%的主要真菌门是子囊菌门(76.7%)、担子菌门(9.8%)、球囊菌门(4.2%)、被孢霉门(Mortierellomycota)(3.5%)和壶菌门(1.3%);类似地,在强KRD下的根际土壤中,相对丰度大于1%的优势真菌门是子囊菌门(78.2%)、担子菌门(6.6%)、球囊菌门(2.2%)、被孢霉门(1.9%)和壶菌门(1.7%);在强KRD条件下,相对丰度大于1%的优势真菌门为子囊菌门(94.5%)、担子菌门(2.1%)和球囊菌门(1.2%)(图3a)。不同程度KRD(DGK)对子囊菌存在显著效应(P=0.002),担子菌门(P <0.001)和壶菌门(P <0.001),以及不同的样点(DS)对子囊菌的效果(P <0.001),壶菌门(P <0.001),球囊菌门(P=0.003)和Mortierellomycota(P <0.001),但DGK×DS的相互作用具有明显地影响对子囊菌(P=0.005),担子菌门(P =0.016)和Mortierellomycota(P =0.034)(表2)。
图3. 非根际、根际和根内生菌真菌群落的相对丰度。(a)门,(b)属。
表2. 不同程度KRD(DGK)和不同位点(DS)对子囊菌、担子菌、壶菌、球囊菌和被孢霉的影响的双因素方差分析结果。
当我们在属水平上调查黄背草的真菌群落时,我们观察到不同地点和KRD程度之间的分类属水平变化更大(图3b)。例如,在所有群落中都观察到镰刀菌属(子囊菌门),但根内生菌在轻度KRD处除外。杯梗孢属在所有根际和根群落中都有发现,但在非根际土壤中没有。最后,被孢霉(PhylumZygomycota)仅在土壤和根际内发现,除了在轻度KRD的非根际土壤中。我们的结果表明,相对丰度超过1%的主要真菌属是湿伞属(10.2%),地舌菌属(7.4%)、镶刀菌属(2.0%)和珊瑚菌属(1.9%)在轻度KRD下的非根际土壤中;主导真菌属的相对丰度分别为大于1%为地舌菌属(9.0%),镰孢属(4.4%),湿伞属(2.5%),被孢霉属(2.3%),赭霉属(1.6%),杯梗孢属(1.2%)和枝孢(1.1%)在轻度KRD下的根际土壤;相对丰度大于1%的优势真菌属是黑团孢属(27.8%),Mycena(15.1%),赭霉属(8.2%),杯梗孢属(1.9%)和枝孢菌(1.3%)在轻度KRD下的根内生真菌(图3b)。此外,相对丰度主导真菌属的大于1%是被孢霉属(3.4%),黑团孢属(3.3%)和镰刀菌(2.9%)在强KRD下的土体;强KRD下的根际土壤中相对丰度大于1%的优势真菌属为镰刀菌属(5.8%)、梨属(5.4%)、被孢霉属(1.9%)、赭霉属(1.3%)和杯梗孢属(1.1%)。此外,我们发现优势真菌属的相对丰度大于1%、黑团孢属(33.4%)、杯梗孢属(6.5%)、Myrmecridium(6.5%)、Sigarispora(3.5%)、镶刀菌属(2.2%)和外瓶柄霉属(1.6%)在根部强KRD下的内生真菌(图3b)。
为了探索真菌群落如何随采样地点和KRD程度而变化,我们对计算出的每个地点之间的Bray-Curtis距离进行了PCoA。前两个主坐标合计占总变异的41.58%。第一个主坐标(27.01%)将群落与非根际土壤和根际与根内生菌群落分开。此外,第二个主坐标(14.57%)根据KRD程度分离群落。然而,每个KRD程度的根内生菌群落之间的差异不如土壤和根际之间的差异明显(图4)。显然,轻度和强烈的KRD能够显著(R2=0.122,P=0.001)分别在土壤和根际和根内生菌中分离(表3)。此外,不同样点差异显著(R2=0.187,P=0.001)分别在非根际土壤、根际和根系内生菌中分离(表3),此外,DGK×DS的相互作用显著(R2=0.048,P=0.021)对非根际土壤、根际和根内生菌的真菌群落的影响(表3)。属水平的热图还表明非根际土壤、根际和根内生菌中真菌群落的模式类似于PCoA中观察到的分组模式(图5)。与根内生菌相比,非根际土壤和根际土壤中的前100属中的大多数具有更高的相对丰度(图5)。
图4. 非根际土壤、根际和根内生菌的真菌群落(Bray-Curtis)的主坐标分析(PCoA)。
表3. 排列多元方差分析(PERMANOVA)的统计检验分析不同程度KRD(DGK)和不同地点(DS)真菌群落的差异。

图5. 非根际、根际土壤和根系内生菌丰富度前100位真菌属在强KRD和弱KRD分布的热图。
4 土壤养分水平的差异与门级真菌群落组成的变化相关为了更好地了解土壤养分含量和真菌群落组成之间的相关性,我们进行了冗余分析(RDA)。前两轴共解释了不同KRD程度的非根际土壤真菌群落之间总差异的88.61%(图6a)。RDA表明SOC、TN、TP、NN、AN、AP含量和pH与子囊菌门、壶菌门、球囊菌门和被孢霉门正相关,与担子菌门负相关(图6a),尤其是AN含量(P =0.041)和pH(P =0.047)是与非根际土壤真菌群落组成差异相关的前两个因素,分别解释了KRD程度之间观察到的变异的21.27%和19.25%。与非根际土壤类似,前两轴解释了不同KRD程度下根际真菌群落之间总差异的82.26%(图6b)。AN、AP、NN、SOC、TN和TP含量和pH值与壶菌门和球藻门正相关。然而,与非根际土壤不同,除了担子菌门外,这些因素还与子囊菌门和被孢霉门呈负相关(图6b)。特别是,AN(P=0.058)和SOC(P=0.075)含量是与真菌根际群落组成差异相关的前两个因素,分别解释了KRD程度之间观察到的变异的21.58%和19.88%。对于不同KRD程度的根内生菌群落,前两轴解释了总方差的76.1%。AN、AP、NN、SOC、TN和TP含量和pH值与子囊菌门、壶菌门和球囊菌门正相关。相反,这些因素与担子菌门和被孢霉门负相关(图6c)。特别是,SOC(P =0.009)和NN(P =0.012)含量是与真菌根内生菌群落组成差异相关的前两个因素,分别解释了KRD程度之间观察到的变异的17.84%和17.03%。
图6. 冗余分析(RDA)分别估计土壤养分(红色箭头)和非根际土壤(黑点)(a)、根际(b)和根内生菌(c)中的真菌门之间的关系。
5 真菌群落丰富度和Shannon多样性指数与土壤养分的相关性Spearman系数的结果发现,大量土壤真菌多样性与土壤养分之间存在明显的相关性(图7)。非根际土壤真菌群落丰富度的变化与TN(P =0.019)和AN(P =0.026)相关,但左侧养分不是与丰富度相关的强因素(图7a);此外,我们发现Shannon多样性指数的变化不是与非根际土壤中土壤养分相关的强因素(图7a);有趣的是,Beta多样性(PCoA1)与TN(P =0.029)、TP(P =0.049)、SOC(P =0.021)、NN(P =0.025)、AN(P =0.04)和AP(P =0.028),但pH值不是与非根际土壤中微生物丰富度、Shannon多样性和PCoA1(图7a)相关的强因素。我们的结果表明,真菌群落丰富度与TN(P =0.002)、TP(P =0.008)、SOC(P =0.003)、NN(P =0.002)、AN(P =0.034)和pH(P =0.045),但AP不是与根际丰富度和Shannon多样性相关的因素(图7b);Shannon与TN(P =0.017),SOC(P =0.013),NN(P =0.024)和AN(P =0.008),但TP、AP和pH与根际Shannon多样性的相关性不强(图7b);Beta多样性(PCoA)与TP(P =0.028)和AP(P =0.009)相关,但TN,SOC,NN,ANpH值与根际PCoA1(图7b)的相关性不强。尽管如此,我们发现Shannon多样性和Beta多样性(PCoA)不是与根内生菌的所有营养物质相关的因素(图7c)。
图7. 土壤养分与真菌多样性(丰富度Richness、Shannon和PCoA)(黑点)之间的Spearman程度相关系数分别在非根际土壤(a)、根际(b)和根内生菌(c)中。
我们的结果表明担子菌仅与NN呈负相关(P=0.037);壶菌门与SOC(P=0.026)、NN(P=0.04)和AN(P=0.03)呈正相关;被孢霉门与非根际土壤中的AN(P=0.012)和pH(P=0.004)呈正相关(图8a)。此外,对于根际门,担子菌与TN(P=0.050)、SOC(P=0.018)、NN(P=0.027)和AN(P=0.020)呈负相关;壶菌门与TN(P=0.016)、SOC(P=0.011),NN(P=0.016)和AN(P=0.010);然而,子囊菌门、球囊菌门和被孢霉门并不是与根际土壤中所有养分相关强的因素(图8b)。对于根内生菌门,子囊菌与TN(P=0.003)、TP(P=0.032)、SOC(P=0.003)、NN(P=0.002)和AN(P=0.021)呈正相关;担子菌与TN(P=0.001)、TP(P=0.015)、SOC(P=0.001)、NN(P=0.001)和AN(P=0.005);但被孢霉门、壶菌门和球藻门并不是与所有养分指标相关性强的因素(图8c)。
图8. 土壤养分与非根际土壤(黑点)(a)、根际(b)和根内生菌(c)中真菌门相对丰度之间的斯皮尔曼程度相关系数。
喀斯特生态系统不稳定,容易退化,失去养分,保水能力下降,最终导致土壤流失和森林砍伐。由于人为活动,喀斯特生态系统很难从这种荒漠化中恢复过来。因此,KRD在中国西南地区变得越来越普遍。恢复KRD的第一步是重建草本植物。KRD对植物群落的影响已经得到很好的研究。然而,真菌群落在KRD恢复过程中所起的作用尚不清楚。因此,本研究对黄背草非根际、根际和根内生真菌群落的结构和多样性进行了评价,探讨了土壤养分与根系内生真菌群落的关系,并探讨了粳稻在轻度和强KRD条件下优势真菌的可能作用。总之,我们的结果有助于理解真菌群落在植物适应不同程度KRD中的作用。
在KRD的发展和演进过程中,这些生态系统的基岩暴露量和生长的植被类型发生了明显的变化。因此,这些过程可能会导致土壤养分含量发生变化,进而影响真菌群落。例如,先前已经证明增加的AN、NN、SOC、TN和TP含量与土壤真菌多样性呈负相关,并且SOC含量驱动真菌群落的多样性。在我们的研究中,我们发现强KRD地区土壤的TN、TP、SOC、NN和AN含量以及pH值显著高于KRD弱地区土壤。这些结果与之前的工作一致,这些工作测量了来自强KRD地区的土壤中较高的有机物质、TN和pH值。这些观察结果可以解释为岩溶地区石灰石的溶解,通过碳酸钙的释放提高了土壤的pH值,并增加了土壤有机物质的水平。事实上,土壤pH值升高是喀斯特土壤荒漠化的最常见指标,并且已知会影响土壤真菌群落。然而,与之前的报告相比,我们观察到从两个不同KRD程度的地点收集的土壤中的AP没有差异,并且发现来自强KRD地区的土壤中的SOC、TN和TP含量更高。这些不一致可能是由于当地土壤微生物群落(例如,固氮细菌)的差异或由于我们在T.japonica植物而不是灌木草地附近取样。在荒漠化严重的喀斯特地区,植物多样性和覆盖率低于KRD不太严重的地区。同样,我们的研究发现,在KRD强的地区,非根际土壤和根际真菌群落的多样性往往较低。一般来说,在整个陆地生态系统中,植物丰富度与真菌丰富度呈正相关,植物物种的多样性和覆盖度在轻度KRD中高于强KRD,因此,本研究中轻度KRD土壤真菌的丰富度高于强KRD。真菌与植物之间相互关联的一种可能解释是土壤养分或pH值水平调节真菌群落,进而影响植物群落。通过控制可用养分和酶的水平和类型,微生物在调节土壤肥力和影响植物生长方面发挥着核心作用。例如,土壤中大量养分和低分子量有机酸的水平先前已被证明可以预测喀斯特生态系统对未来退化的反应。因此,了解植物相关真菌群落如何响应KRD的变化可能使我们能够识别特定的真菌类群,以防止未来退化或促进植被生长,并有助于修复具有强KRD的区域。已知喀斯特地区土壤荒漠化的严重程度会影响真菌群落。然而,据我们所知,这是首次对同一种植物(T. japonica)在不同KRD程度下的真菌群落进行特征研究。真菌门子囊菌门、担子菌门和在较小程度上的被孢霉门主导了我们分析的所有群落,无论采样位置或KRD程度如何。这种模式类似于之前在干旱农田真菌群落中观察到的模式,这些群落由相同的门组成。子囊菌门和被孢霉门的成员可以在根际迅速分解有机物质,并且已知它们的丰富度受土壤养分的调节。我们发现子囊菌和被孢霉的相对丰度在分离自强KRD区域的非根际土壤中较高,但在相同条件下在根际较低。子囊菌在土壤中的一个潜在功能可能是通过分泌更多降解植物的酶来促进土壤氮的积累。在从地区土壤具有很强的KRD,主要真菌属先前报道,赤霉菌和镰刀,而属黑,Geomyces和镰刀与轻度KRD地区为主的土壤群落。在我们的研究中,我们发现从不同KRD程度的地区采集的样品在非根际土壤、根际和根中的真菌群落结构存在显著差异。具体而言,从轻度的KRD区域的样本,我们发现属地舌菌属和湿伞属非根际土壤,主导地舌菌属和镰刀菌属以根际为主,小菇属和黑团孢属以根为主。相比之下,在来自强KRD区域的样本中,我们发现镰刀菌属在强KRD中以这些位点为主。我们在此注意到这些特定属与之前的研究不一致。不一致可能是由于采样地点之间植物多样性和土壤特性的差异。在不同KRD级别分离的真菌群落之间的差异在门水平上更为明显,部分原因是本研究中使用的ITS2扩增子引物的属级分辨率有限。不同程度KRD植物多样性不同,一项研究表明植物丰富度增加了土壤真菌群落的多样性,轻度KRD的植物丰富度高于对应的KRD强KRD,因此,轻度KRD中真菌群落的丰富度高于非根际土壤和根际强KRD的对应物。但根系内生真菌群落丰富度在两个程度KRD之间并无显著差异,在植物长期进化过程中,即使在不同的生长环境下,内生真菌群落的变化也可能不大。因为环境对根际微生物影响很大。岩溶地区土壤的持水能力较弱,植物为了生长发育了根系结构,因此根际与非根际土壤紧密相连,非根际土壤和根际真菌群落的丰富程度可能没有显著差异。非根际土壤、根际和根系内生真菌群落的结构通常与土壤养分水平、土壤酶和气候等环境因素密切相关。特别是,资源可用性可以推动根相关真菌群落的变化。例如,根相关真菌群落的结构Salixarctica与不同地点的土壤AN、AP、NN含量和pH值密切相关。与这个想法一致,我们发现绝对养分含量以及土壤养分与真菌群落结构之间的关系在不同KRD程度的地点都不同。特别是,我们发现AN和SOC含量以及pH值是影响非根际、根际和根内生真菌群落之间主要门差异的最重要因素。我们推测,在强KRD环境中可利用的养分水平增加或T. japonica改变的根系分泌物在不同环境中生长的植物会直接影响真菌群落的结构和多样性。此外,一项研究表明,植被恢复过程中不同的土壤性质和类群之间的潜在相互作用可能会影响KRD地区土壤细菌群落的结构和多样性。KRD的恢复伴随着植被恢复,因此,细菌群落可能在KRD恢复过程中也发挥了重要作用。土壤细菌群落多样性与土壤养分(SOC和TN)呈负相关,可能与粳稻非根际土壤、根际和根的组成和多样性有关不同程度KRD之间存在差异,今后还应重点研究粳稻植物适应不同程度KRD过程中细菌的功能。此外,细菌-真菌相互作用也很重要,不容忽视,因此,未来我们还应重点研究细菌-真菌相互作用及其功能。总之,我们研究的主要发现是,强KRD区的土壤养分(SOC、TN、TP、AN和NN)含量和pH值高于轻度KRD。此外,强KRD土壤和根际真菌群落丰富度低于轻度,强KRD根际真菌群落Shannon多样性指数低于轻度KRD。子囊菌门和担子菌门是在轻度KRD和强KRD下非根际土壤、根际和根部的优势真菌门。重要的是,在轻度KRD下的根内生真菌中未发现被孢霉属;油壶菌门仅存在于强KRD下的非根际土壤和根际。PCoA的结果表明,在轻度KRD和强KRD下,真菌群落在非根际土壤、根际和根内生菌中分离。SOC和AN含量以及pH值是驱动非根际土壤、根际和根内生菌中优势真菌门变化的核心因素。此外,TN和AN与非根际土壤和根际真菌群落丰富度指数呈负相关;TP和AP与非根际土壤和根际真菌群落的β多样性呈负相关;然而,所有土壤养分和土壤pH值与根内生菌中真菌群落的丰富度、Shannon多样性和PCoA1无关。我们的研究结果突出了真菌群落对KRD程度和区域(非根际、根际、根系)的不同响应,并进一步阐明了真菌群落的结构和多样性及其与岩石过程中土壤养分的关系,为石漠化治理提供理论依据。石漠化生态系统的土壤质量差,有效磷和水分水平低,极大地限制了植物的生长。此外,土壤微生物在喀斯特地区不同程度KRD恢复和土地利用类型变化中发挥着重要作用。然而,目前还不清楚土壤微生物,特别是真菌和草地之间的相互作用是如何促进喀斯特地区的恢复。通过ITS2扩增子测序分析了在强和轻度KRD下在非根际、根际和Themeda japonica根系中定殖的真菌。通过冗余分析(RDA)和Spearman分析估计土壤养分与真菌多样性之间的关系。研究通过分析不同程度KRD地区的土壤化学和真菌群落的差异,探究了草在从强KRD恢复到轻度KRD的过程中是如何生长的,并确定了影响这种恢复过程的真菌类群,该研究有助于深入了解Themeda japonica在石漠化恢复过程中的作用,也有助于了解喀斯特石漠化环境中草地的微生物功能,给予喀斯特地区石漠化恢复的数据支撑。












