我行我show!中国医院管理案例评选,医院卓越管理实践大秀场。
点击查看
编译:微科盟雪花飘飘 ,编辑:微科盟木木夕、江舜尧。
微科盟原创微文,欢迎转发转载,转载须注明来源《微生态》公众号。
导读
化疗治疗与急性行为副作用(疲劳、厌食)相关,这些副作用显著降低患者的生活质量,并且具有剂量限制性,从而增加死亡率。但目前在接受化疗的患者中,潜在的肠-脑通路还不清楚。在这里,作者的目的是确定化疗相关的肠道操作在多大程度上调节化疗的行为和生物学后果。作者测量了常规或无菌雌性小鼠的疾病行为、外周和中枢炎症介质以及焦虑情况,分别进行3种操作:1)与另一个治疗组的小鼠同居,2)用广谱抗生素进行预处理,3)给化疗小鼠灌胃肠道内容物。通过研究发现,在同居研究中,假定共食促进了体重恢复,但没有观察到与炎症和行为的强烈关联。通过抗生素减少肠道微生物α多样性并不能预防化疗相关的副作用,但是Tyzzerella属、Romboutsia属和Turicibacter属的相对丰度与循环炎症(IL-1)相关。此外,与接受载体治疗小鼠移植的无菌小鼠相比,接受化疗小鼠肠道微生物群移植的无菌小鼠在野外试验中减少了中枢运动,增加了循环CXCL1。综合起来,这些数据提供了进一步的证据,表明肠道微生物群可能有助于化疗相关副作用的发展。这项工作对今后治疗焦虑症患者有重要意义,并保证今后使用基于微生物的治疗方案进行研究。
原名:Manipulations of the gut microbiome alter chemotherapy-induced inflammation and behavioral side effects in female mice
译名:肠道微生物组的操作改变化疗诱导的雌性小鼠炎症和行为副作用
期刊:Brain Behavior and Immunity
IF:7.217
发表时间:2021.4.22
通讯作者:L.M.Pyter
通讯作者单位:美国俄亥俄州立大学
首先分别进行3种操作:1)与同种混笼伴侣同居;2)抗生素治疗及联合化疗;3)化疗小鼠的肠道微生物转移。测试发生在黑暗的早期阶段(1800-2100小时),在微弱的红光下,小鼠被放置在一个16×16英寸的小房间的一角。竞技场有一层稀疏的玉米芯被褥,允许探索30分钟,以测量焦虑样行为(中心倾向)和一般运动。对于实验1和实验2,将竞技场放置在一个光束框架内,并使用PAS Data Reporter自动化软件分析运动、XY移动距离或光束中断的测量。在实验3中,玉米芯被排除在供体和受体小鼠的竞技场之外,以防止在灵长类动物的住房中受到感染。在竞技场的活动被录像,运动的测量被用自动的AnyMaze行为追踪软件获得。随后利用OSU小动物成像核心设施EchoMRI分析仪对MRI身体成分进行分析。所有组织收集都在早期黑暗阶段(1400-1700h)收集,进行血浆细胞因子/趋化因子的浓度;定量RT-PCR;16SrRNA细菌基因测序及短链脂肪酸浓度的测定。
将小鼠与笼中伙伴一起饲养,笼中伙伴接受相同的治疗,或者接受相反的治疗:1只载体小鼠(受试者)与3只化疗小鼠一起饲养,或者1只化疗小鼠(受试者)与3只载体小鼠一起饲养。这种同居安排导致用紫杉醇处理的小鼠饲养的载体小鼠的体重比仅用其他载体处理的小鼠饲养的载体处理的小鼠的体重减少(图1A;Veh相同vs Veh混合:第5天t(20)=2.4,p<0.05;第11天t(20)=2.3,p<0.05,三因素方差分析主效应,F7,77=5.6,p<0.0001)。在混合饲养条件下的小鼠在第11天和第13天的体重比只在同一笼中饲养的小鼠减轻了一半。化疗增加了焦虑样行为,这反映在开阔视野试验中中心倾向的降低(图1C;F1.40=8.9,p<0.005,Veh混合与化疗混合,p<0.05)。通过测定末次化疗后6h小鼠血浆中促炎细胞因子IL-β、TNFα和IL-6的浓度来评价外周炎症(分别为图1D、E和F)。化疗治疗显著增加了循环中的IL-β、TNFα和IL-6(图1D;IL-1β, F1,33 = 9.9, p < 0.005,Veh与化疗相同,p<0.005;图1E;TNFα, F1,34 = 7.5, p<0.01,Veh混合组与化疗混合组比较p<0.05;图1F;F1,33=36.5,p<0.0001,Veh相同vs化疗相同p<0.005,Veh混合vs化疗混合p<0.001)。混合居住显著减弱化疗诱导的IL-1β升高, 是由化疗混合组与化疗相同组的减少所驱动的(图1D;住房效应,F1,33=5.9,p<0.05;药物×外壳相互作用,F1,33=5.9,p<0.05;化疗相同与化疗混合(p<0.01)。
A)体重与注射第一天的体重相比变化的百分比。*p<0.05。B)通过最后注射后第6天(即下午组织采集前早上)测量身体脂肪的百分比。*p<0.05,t-检验。C)在开放场室中心通过光束断裂测量的运动百分比。MSD多重细胞因子最后注射6小时后,通过双向anova和Tukey的多重比较试验*p<0.05、**p<0.01。D)<IL-1β、E)TNFα、F)IL-6测定的意义。由双向anova和Tukey的多重比较测试确定的意义,**p<0.05,**p<0.01、***p<0.001、****p<0.0001。平均值±SEM。2 抗生素显著改变了肠道微生物群,而没有改变化疗相关的神经炎症和行为后果正如预期的那样,长期食用抗生素会导致整体α多样性(补充图1,补充图2A)和结肠中大约100个属的相对丰度的具体减少(补充表1)。此外,Bray-Curtis(多样性)距离聚集的动物(图2A;抗生素效应p=0.001,化疗效应p=0.02)。无论药物治疗,抗生素都倾向于降低弯曲杆菌和弯曲杆菌的相对丰度(图2B和C;抗生素效应A. F1,23=3.9,p=0.06,Chemo vs Chemo+Abx,U=8,p<0.005 B. F1,21=3.9、p=0.06、Chemo vs Chemo+Abx、U=0、p<0.001、补充图2B和2C),大大降低了小球藻的相对丰度(图2D;F1,22=8.2、p<0.01、补充图2D),化疗往往增加红杆菌、弯曲杆菌和小球藻(图2B-D;化疗效果 B. F1,23=3.9,p=0.06,Veh vs Chemo,U=5,p<0.05 C. F1,21=3.6,p=0.07,Veh vs Chemo,U=1,p<0.01和 D. F1,22=4.1,p=0.06,Veh vs Chemo,U=6.5,p=0.05,补充图2B-D)。相反,在抗生素治疗的小鼠中,大肠杆菌和乳酸杆菌的相对丰度,无论化疗,都显著增加(补充图1E和F,以及补充图3)同样,化疗增加了类似焦虑的行为,通过开放领域的中心倾向来衡量。图2E; F1,26=11.5,P<0.01,Veh vs Chemo, P<0.005)。抗生素倾向于减少中心倾向,由于Veh和Chemo组与Veh控制组相比,抗生素和化疗之间的显著相互作用(图2E;抗生素作用,F1,26=3.1,p=0.090;通过抗生素相互作用进行化疗,F1,26=7.1,p<0.05,Veh vs Veh + Abx,p<0.001)。在开放野外测试中,化疗显著减少了疲劳的测量。图2F;F1,25=19.9,p<0.001,Veh vs Chemo,p=0.06,Veh +Abx vs Chemo+Abx,p<0.01),而抗生素对运动没有影响。完成了细菌属、炎症结果和行为结果之间的相关分析,通过治疗显著改变,以检验一个先验假设,即微生物丰度可以预测化疗相关的炎症和行为副作用。在没有抗生素的化疗小鼠远端结肠中,瘤的相对丰度增强,与开放野外试验中测量的类似焦虑的行为(即中心趋势降低)相关。2H;化学试剂组,r=−0.88,p<0.01)。此外,无抗生素的化疗小鼠的远端结肠结肠杆菌的相对增加与嗜睡(即运动下降)有关。图2I;化学试剂组,r=−0.733,p<0.05)。类型相对丰度的增加与神经炎症正相关(即海马IL-1β浓度)(图2J;化学试剂组,r=0.85,p<0.01)。肠道微生物群的成分差异会导致其代谢活性的差异。考虑到化疗小鼠的微生物组成和行为的改变(图2B-D)。研究了对已知沿肠脑轴发出信号的代谢物进行了修改。化疗不影响总短链脂肪酸、醋酸、丙酸、丁酸或丁酸的结肠浓度(表1)。正如预期的那样,抗生素治疗显著降低了近端和远端结肠中总短链脂肪酸、乙酸盐、丙酸盐和丁酸盐的浓度(表1)。有趣的是,远端结肠丙酸盐浓度存在抗生素相互作用的化疗;化疗降低了丙酸的浓度,但是相对于用Veh+Abx治疗的小鼠,Chemo+Abx升高了丙酸的浓度(表1;F1,18=6.3,p<0.05)。

图2 化疗和抗生素对肠道微生物组、行为和炎症的影响A) Bray-Curtis距离(β多样性的度量)原理坐标图。在最后一次注射载体或化疗的同一天,评估小鼠远端结肠中B)Romboutsia、C)Turicibacer和D)Tyzzerella的相对丰度。n=8–13。E)中心趋势,由束流中断计算,在30分钟试验的最终注入后6小时测量。n=6–9。F)在30分钟的试验中,最终注入6小时后,在开阔场地竞技场中通过光束断裂测量的运动。n=6–9。G)IL-1β 最后一次注射后当天在小鼠海马区。无显著性比较,n=5–9。H)化疗组Romboutsia相对丰度与中心趋势的相关图,Spearman r=-0.88,p=0.0034。n=9。I)化疗组土杆菌相对丰度与运动的相关图,Spearman r=-0.73,p=0.031。n=9。J)Tyzzerella与海马IL-1相对丰度的相关图β 化疗组Spearman r=0.85,p=0.0061,n=9。平均值±SEM。*p<0.05,**p<0.01,***p<0.005。3 化疗小鼠肠道微生物群移植(GMT)导致受体小鼠出现焦虑样行为和炎症为了直接测试微生物成分对炎症和行为反应的影响,将化疗或载体处理的常规供体小鼠的肠道微生物(盲肠和近端结肠内容物)作为单一胃内灌胃移植给无菌受体小鼠(图3A)。正如预期的那样,接受化疗的供体小鼠从治疗开始到治疗结束时体重减轻,而载体治疗的供体小鼠体重保持不变(图3B;F1,19=24.55,p<0.0001,Veh供体与化疗供体比较,p<0.0001)。在以前的无菌受者中,Veh受者和化疗受者小鼠从GMT到行为测试日(灌胃后7天)体重均未下降。接受化疗的供体小鼠进食量减少,但Veh-GMT和Chemo-GMT小鼠的进食量没有差异(图3C;Veh供体与化疗供体比较,U=13,p<0.05)。为了确保微生物组分的成功传播并评估治疗诱导的差异,对Veh-GMT和Chemo-GMT小鼠的样本以及GMT材料进行了16srrna基因测序。表示成功的GMT,每组受试者按Bray-Curtis(β多样性)距离聚集(图3D)。β多样性的差异是由属水平上微生物相对丰度的改变所支撑的。与Veh GMT小鼠相比,化学GMT小鼠近端结肠中的埃斯佩拉托梭状芽胞杆菌、未培养的红螺旋体、瘤胃球菌1、拉克斯皮科UCG-006、未培养的埃斯佩洛三叉科、肠单胞菌、瘤胃球菌2和艾森伯格菌的相对丰度存在显著差异(图3E)。化疗后小鼠转为无菌小鼠的GMT在野外试验中表现为一种行为表型的改变。与先前的实验一致,与载体治疗的供体小鼠相比,化疗减少了常规供体小鼠的总行程、外周行程和中心行程(图4A;Veh供体与化疗供体;总计,t(17)=5.0,p=0.0001;周边,t(17)=4.4,p<0.001;中心,U=11,p<0.005)。与GMT Veh小鼠相比,GMT化疗没有减少总的或周围的移动距离,但是在开阔野室中心的移动距离特别减少,与化疗治疗的供体小鼠相似(图4A;Veh-GMT vs-Chemo-GMT,t(13)=2.3,p<0.05)。供体和受体小鼠的外周和中枢炎症介质水平均升高。例如,在供体小鼠中,与载体治疗相比,化疗治疗增加了IL-6的循环浓度(图4B;Veh供体vs化疗供体,U=15,p<0.05)和化疗GMT比Veh GMT升高CXCL1血浆浓度(图4B;Veh-GMT vs-Chemo-GMT,t(14)=2.7,p<0.05)。同样,化疗增加了海马mRNA水平的Il1b和Tnfa相比,车辆在供体小鼠(图4C;Veh供体与化疗供体;Il1b,U=22,p=0.01,Tnfa,U=26,p<0.05)和化疗GMT使受体小鼠海马Il6和Tnfa的mRNA增加(图4C;Veh-GMT与Chemo-GMT;Il6,t(13)=2.5,p<0.05,Tnfa,t(13)=2.0,p=0.07)。化疗或化疗GMT增加了供体或受体小鼠下丘脑或额叶皮质的炎症基因表达(补充图4A和B)
A)供体小鼠向无菌受体小鼠注射赋形剂或化疗药物以及盲肠和近端结肠内容物的胃内灌胃(肠道微生物群移植,GMT),行为测试和组织收集的时间表图。B)供体(从第一次注射到最后一次注射)和受体(从GMT到GMT后时间点)小鼠体重的百分比变化。药物效应,通过双向方差分析和Bonferroni多重比较检验****p<0.0001,n=9–12。C)供体小鼠在过去48小时内以及从格林尼治标准时间到受体小鼠组织采集日的平均食物摄入量/小鼠/笼子/24小时。Mann-Whitney非参数检验确定Veh供体与化疗供体的差异,*p<0.05。n=3–8。平均值± SEM。D)Brey-Curtis距离原理坐标图A)Veh-GMT和Chemo-GMT小鼠近端结肠内容物(分别为灰色和蓝色圆圈)以及Veh供体和Chemo供体材料(黑色圆圈)中多种细菌属的相对丰度(%)(有关此图例中颜色的说明,请参阅本文的网络版)。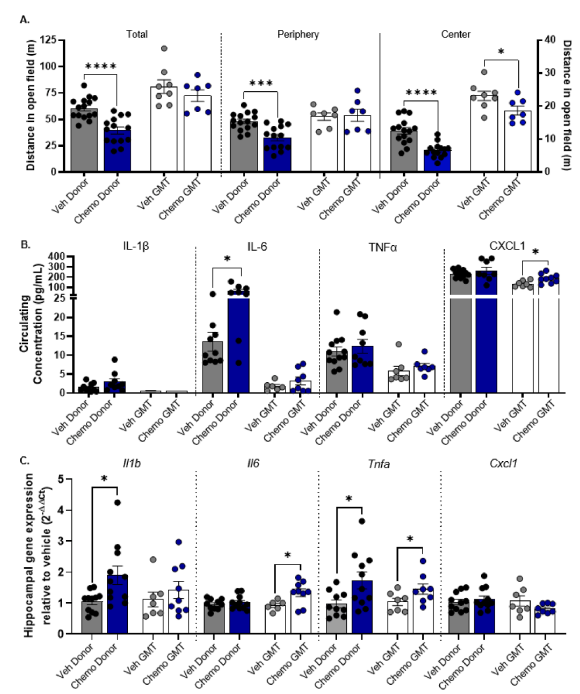
A)总距离、外围距离和中心距离× 16开放场地竞技场30分钟以上。非配对t检验或Mann-Whitney非参数检验,*p<0.05,**p<0.01,***p<0.005,n=7–15。B)白细胞介素-1β, 白细胞介素-6、肿瘤坏死因子α, 用多重细胞因子阵列测定供、受体小鼠组织采集当天血浆CXCL1水平。白细胞介素-1β 在Veh-GMT或Chemo-GMT组中未检测到。非配对t检验或Mann-Whitney非参数检验,*p<0.05,n=7-12。C)用RT-qPCR检测海马Il1b、Il6、Tnfa和Cxcl1的mRNA表达,与Veh供体或Veh-GMT相比呈倍数变化。未配对t检验,*p<0.05。n=7–11。平均值 ± SEM。由于疲劳、焦虑和胃肠道窘迫等副作用,癌症治疗会显著降低患者的生活质量和治疗依从性。很明显,肠道微生物种群的改变会影响这些心理和身体健康的结果,尽管这种关系尚未在化疗中进行研究。作者之前的研究建立了小鼠肠道微生物群落的变化、炎症和化疗诱导的小鼠行为副作用之间的相关性。而在本研究中,作者使用多管齐下的方法来识别肠道微生物组在急性化疗相关的炎症和疲劳发展中的作用。使用粪便微生物群移植方法研究大脑和行为的一个局限性是胃内胃对这些终点的混杂压力效应。因此,在我们的第一个实验中,我们利用小鼠自然参与共噬的倾向,从而不侵入地交换粪便微生物。与无法参与副菌的小鼠相比,副菌对胃肠道的微生物组成有显著影响,增加了微生物负荷,改变了生物多样性。为了增加试验小鼠从相反处理的小鼠中摄取粪便的可能性,实验设计为每3只接受相反处理的笼友配1只试验小鼠。然而,值得注意的是,在一个笼子里的所有小鼠之间可能会发生共食,并且这里报告的研究没有量化微生物转移的数量,不过,微生物的转移以前已经被记录在案。在这里,与化疗治疗小鼠一起饲养的载体治疗小鼠的体脂比一起饲养的载体治疗小鼠的体脂少,并且与化疗治疗小鼠的体脂组成大致相同。这些数据表明,消耗粪便可以转移化疗相关的身体成分,并且基于先前的研究,可能转移化疗相关的代谢激素信号。这一发现得到了一份报告的支持,即肥胖和瘦双胞胎小鼠FMT受体的混合住房阻止了传递肥胖表型的能力,这是在两种治疗方法之间不混合住房时观察到的。此外,新辅助化疗可减少食管胃癌患者的脂肪量。与作者之前在Balb/c和C57BL/6小鼠中的数据一致,本研究中紫杉醇治疗后促炎细胞因子、IL-1β、TNF-α和IL-6升高。在与载体治疗小鼠共存的化疗治疗小鼠中,循环中的IL-1β的浓度显著降低,这表明从健康对照小鼠那里获得的微生物可能会减弱IL-1β对化疗的反应。除了影响身体成分和炎症的循环标记物外,几乎没有其他强大的共同外壳效应;然而,目前的结果需要使用更具侵入性的方法进行后续调查。作为一种研究肠道微生物组的更受控制的方法,肠道微生物组在多大程度上驱动化疗引起的炎症和行为的变化,在注射车辆或紫杉醇之前和期间注射含有抗生素鸡尾酒的小鼠。与车辆使用抗生素的小鼠相比,持续使用抗生素有力地改变了肠道微生物的组成,并显著抑制了无抗生素化疗治疗的小鼠中增加的微生物的相对丰度。抗生素和化疗治疗的小鼠结肠微生物谱的改变提供了将行为和炎症谱与化疗治疗小鼠的微生物相关联的机会。与作者之前的研究类似,化疗导致Romboutsia增加。焦虑样行为与Romboutsia和Turicibacter的相关性表明这些微生物在焦虑样表型的形成中起作用。需要进行进一步的实验,特别是增加小鼠体内Romboutsia和Turicibacter的相对丰度,以支持这些微生物在行为副作用发展中的因果作用。在由慢性不可预测的轻度应激(CMS)诱导的小鼠焦虑模型中,Romboutsia也增加,进一步暗示该属与焦虑之间的关系。目前观察到的海马IL-1β和球藻相对丰度之间的正相关表明,化疗后该属的相对增加可能部分导致神经炎症。综上所述,这些相关性进一步支持了化疗-肠道-微生物-脑轴的证据,并揭示了新的微生物类群作为潜在的干预目标。值得注意的是,在长期使用广谱抗生素chow治疗后,存活下来的细菌种类很少。然而,由抗生素引起的乳酸杆菌相对丰度的显著增加,与文献记载的对抗生素的相对高耐药率相一致。有趣的是,乳酸杆菌常常与肠道健康有关。相反,在抗生素治疗的动物中,大肠杆菌(一种常见的病原体)的相对丰度增加,并且通过化疗进一步升高。同时,促炎介质IL-1β, 在接受抗生素治疗的小鼠的额叶皮质增加,而化疗加重了这种情况。这表明化疗可以选择性地促进肠道细菌的生长,从而调节脑部炎症。与之前的研究不同,作者并没有证明化疗诱导的α多样性的降低。然而,考虑到近交系小鼠之间,特别是BALB/c和C57BL/6(此处显示)小鼠之间肠道微生物组的差异,这并不意外。值得注意的是,对照组小鼠中,抗生素单独改变了行为,可能是由SCFA浓度的同时改变引起的,表现为焦虑样行为的增加(即中枢倾向的降低)。这与先前的一项研究一致,在雄性幼年BALB/c小鼠中,氨苄西林减少了在开阔视野室中的中心距离,增加了在高架+迷宫封闭臂中花费的时间,这两种行为都是焦虑样的。同样,抗生素增加了大脑中的促炎细胞因子。在这项研究中,他们证明了早期接触青霉素会导致小鼠大脑中促炎细胞因子的增加。虽然本实验的假设是抗生素诱导的肠道微生物减少会减轻化疗对炎症和脑介导的副作用的影响,但可以肯定的是,抗生素剂量的延长掩盖了由微生物组引起的化疗副作用的缓解。研究人员分析了小鼠结肠内容物中的短链脂肪酸(SCFAs)、乙酸盐、丙酸盐和丁酸盐,并将其扩展到其他可能与炎症以外的化疗有关的肠-脑通路。下消化道中的细菌发酵产生SCFAs,与脑功能有关,包括小胶质细胞成熟和维持血脑屏障完整性。重要的是,摄入低聚果糖和半乳糖可增加小鼠盲肠中SCFAs的含量,并减少开阔视野试验和高架十字迷宫中的焦虑样行为。在这里,作者假设化疗减少了小鼠结肠中的SCFAs,并与焦虑样行为增加相关。然而,观察到的唯一由化疗引起的差异是抗生素引起的载体治疗小鼠远端结肠丙酸盐浓度的降低,而化疗治疗小鼠没有。为了完全排除SCFA肠-脑通路与化疗的可能性,未来的研究应评估其他胃肠区域和循环中的SCFA。如上所述,应该注意的是,在接受化疗之前和通过11天的治疗方案之前,本实验中的小鼠接受中等剂量的抗生素8天。因此,如果使用较低剂量的抗生素或缩短疗程,可能会发现抗生素相互作用导致的潜在化疗。确定肠道微生物群与化疗相关神经炎症和行为副作用之间潜在因果关系的最终方法是胃内灌胃(即肠道微生物群移植,从化疗或载体治疗的常规供体小鼠到无菌受体小鼠的盲肠和近端结肠内容物。值得注意的是,虽然紫杉醇的浓度可以忽略不计,但这种肠道内容物可能不仅仅包含细菌(例如,药物代谢物、细菌代谢物、病毒等)。在接受GMT化疗的无菌小鼠中,由于没有体重减轻和厌食症,GMT不能改变疾病行为,接受GMT治疗的受体小鼠的肠道微生物组成与Veh-GMT组和Chemo-GMT组的Bray-Curtis距离测定的供体材料的微生物组成聚集在一起。值得注意的是,GMT足以转移化疗的选择性行为副作用。在所有3个实验中,接受供体化疗的小鼠表现出类似焦虑的行为,这种行为被传递给了他们的GMT接受者。相反,捐赠者的嗜睡表型不是通过GMT传递的。综合这些数据表明,与化疗相关的焦虑样行为可能更直接地由肠道微生物介导,而嗜睡可能是紫杉醇治疗的直接结果。肠道微生物编码焦虑样行为信号的能力也通过无菌NIH瑞士小鼠(不太焦虑)与BALB/C小鼠(更焦虑)的微生物的定植来证明,这导致NIH瑞士小鼠的降压潜伏期增加。此外,CMS诱导焦虑样行为,这是由开放场和高架+迷宫试验确定的,并且该表型转移到接受CMS供体粪便微生物群移植的小鼠。在供体小鼠中观察到循环中的炎性细胞因子和趋化因子升高以及海马炎性基因表达升高,并且通过GMT将循环中的炎性趋化因子升高显著地转移到受体小鼠中。在一项关于高脂饮食;对照组小鼠粪便移植可减轻炎症。这表明肠道微生物有助于发展外周和中枢炎症由于化疗治疗。这并不奇怪,完全相同的炎症标记物在供体和受体小鼠中没有升高,因为炎症途径是高度冗余和代偿性的,并且依赖于肠道微生物组成。事实上,无菌小鼠肠道生理和微生物组与供体小鼠相似所需的时间可能需要长达9周的定植期。本文首次采用了多方面的方法来证明紫杉醇化疗诱导的肠道微生物群破坏与随后的炎症和行为改变之间的明确关联,该数据对心理神经免疫学领域做出了重大贡献。未来的研究将肿瘤暴露和手术添加到模型中,以确定这些关键癌症治疗事件之间的潜在相互作用,即微生物组与化疗副作用之间的关系。目前的研究结果证明,通过使用益生元、益生菌或微生物移植疗法来预防和治疗化疗引起的行为症状的可能性值得进一步研究。这种治疗策略的使用将彻底改变癌症治疗,导致患者生活质量的显著提高和死亡率的降低。





 打赏
打赏


















 010-82736610
010-82736610
 股票代码: 872612
股票代码: 872612




 京公网安备 11010802020745号
京公网安备 11010802020745号


