导读
颗粒污泥具有沉降速度快、负载率高以及抗抑制能力较强等特征,是培养生长缓慢及敏感性微生物(例如,厌氧氨氧化(anammox)细菌和亚硝酸盐/硝酸盐型厌氧甲烷氧化(n-DAMO)微生物)的理想平台。尽管anammox颗粒污泥已被广泛应用,但目前学界对如何加速n-DAMO微生物(生长速率较anammox菌更为缓慢)的颗粒化进程却知之甚少。在这项研究中,我们使用成熟的anammox颗粒污泥作为生物载体来包埋n-DAMO微生物,从而在6个月内获得了anammox细菌+ n-DAMO微生物的复合颗粒污泥。全颗粒的16S rRNA基因扩增子测序结果表明,anammox细菌、n-DAMO细菌和n-DAMO古菌共存于颗粒中。研究通过冷冻切片-16S rRNA基因扩增子测序进一步阐明了颗粒径向的微生物分层:n-DAMO古菌和anammox细菌分别在颗粒内层和外层占据主导地位。此外,冷冻切片-荧光原位杂交(FISH)图像验证了这种分层特征,揭示了微生物分层的动态演替。具体而言,最初n-DAMO细菌和n-DAMO古菌附着于anammox颗粒表面,于实验运行4个月后移至内层。在anammox细菌+ n-DAMO微生物组合的基础上,颗粒污泥被用于侧流污水处理的实际脱氮速率达到1.0 kg N/m3/d,为利用甲烷碳源用于污水脱氮提供了新途径。
原名:Rapid formation of granules coupling n-DAMO and anammox microorganisms to remove nitrogen
译名:厌氧氨氧化耦合n-DAMO微生物脱氮颗粒污泥的快速形成
期刊:Water Research
IF:9.130
发表时间:2021.4.23
通讯作者:郭建华
通讯作者单位:澳大利亚昆士兰大学水管理高等研究中心

图1 实验设计与方法。

图片摘要
1 从厌氧氨氧化颗粒污泥到n-DAMO厌氧氨氧化复合颗粒污泥

图
2 长期脱氮性能。(A)进水和出水中亚硝酸盐、铵和硝酸盐的浓度;(B)TN去除效率和氮转化速率(rAN: anammox细菌的亚硝酸盐去除速率、rDB: n-DAMO细菌的亚硝酸盐去除速率、rDA: n-DAMO古菌的硝酸盐去除速率);(C)第Ⅱ阶段氮浓度的变化;(D)第Ⅱ阶段的氮转化速率。UASB自构建起在整个实验过程中共运行271天,涉及三个阶段(表1)。第Ⅰ阶段,未提供甲烷,获得成熟的
anammox
颗粒污泥。随着anammox细菌活性增加,HRT在第29天(图2 A)由2.0 d降至1.0 d。出水TN浓度为173.2±25.3 mg N/L,包含残余铵96.7±18.3 mg N/L、残余硝酸盐为75.1±18.8 mg N/L(图2 A)。同时,出水中的亚硝酸盐浓度一致维持在1.0 mg N/L以下。相应地,亚硝酸盐于铵的去除比为1.36±0.06,与厌氧氨氧化反应化学计量比相符(理论比为1.32)。总体上总氮去除率为83.5±2.4%(图2 B),与其他相同水平的厌氧氨氧化体系相一致。第100天时n-DAMO微生物接种于anammox颗粒污泥体系,通过中空纤维膜提供甲烷并手动添加储备溶液以补充铵和硝酸盐(第Ⅱ阶段)。如图2 C所示,每次补充储备液后,铵和硝酸盐浓度逐渐下降,亚硝酸盐浓度则立即低于1.0 mg N/L。这一现象表明,n-DAMO古菌(将硝酸盐还原为亚硝酸盐)的活性是限制性步骤。与此同时,体系中的液相逐渐清澈,大部分在接种的n-DAMO生物量已附着于颗粒表面。对应这一现象,n-DAMO古菌的活性也从9.0 mg N/L/d(第100-104天)增加到34.0 mg N/L/d(第142-144天)(图2 D)。第145天,合成侧流污水以3.7 d(第Ⅲ阶段)的初始HRT连续注入系统,HRT根据第Ⅱ阶段末的硝酸盐去除速率决定。尽管亚硝酸盐和硝酸盐浓度均低于1.0 mg N/L,出水的铵浓度于第146天暂时仅降至23.2mg N/L,然后再第158天降至2.1 mg N/L(图2 A)。为进一步提高氮负荷,HRT在第159天降至2.8 d。同样地,出水亚硝酸盐和硝酸盐浓度仍然很低,为1.0 mg N/L,而铵浓度在第160天增加到18.2 mg N/L,然后在第170天降至1.6 mg N/L。当HRT在第175天降至2.2 d时,也观察到类似的现象。然而,当HRT在187天进一步下降到2.0 d,不仅铵而且硝酸盐开始积累。HRT为2.0 d时硝酸盐平均浓度为5.8 mg N/L(第187-198天),当HRT为1.8 d(第199-205天)和1.6 d(第206-216天)时,硝酸盐平均浓度上升到11.1 mg N/L和 24.7 mg N/L。最后当HRT为1.0 d时,废水中的硝酸盐平均浓度为26.6 mg N/L。与没有甲烷供应的第一阶段相比,TN去除效率从83.5±2.4%显著提高到94.8±2.4%(p < 0.01)(图2 B)。随着HRT从3.7 d逐步降至1.0 d,TN去除率从第Ⅲ阶段的0.3 kgN/m3/d提高到1.0 kgN/m3/d。根据三种微生物反应方程计算各反应的贡献,呈现于图2 B中。首先,anammox细菌的活性几乎比n-DAMO细菌和n-DAMO古菌高一个数量级,表明厌氧氨氧化过程促成了该颗粒污泥系统中大部分氮的去除。此外,随着HRT的缩短,anammox细菌的亚硝酸盐去除速率(rAN)逐步提高,显示该颗粒系统高效脱氮的能力。相比之下,n-DAMO细菌的亚硝酸盐去除速率(rDB)没有呈现明显的趋势,在平均值仅为11.5 mg N/L/d的低水平波动。与 HRT为1.0 d时的平均rAN(629.3 mg N/L/d)相比,n-DAMO 细菌仅贡献约 2.0%的亚硝酸盐去除,表明anammox细菌在亚硝酸盐的竞争中胜过n-DAMO细菌,与两种微生物动力学参数差异相符(亚硝酸盐亲和力常数方面,n-DAMO细菌为 0.1mg N/L,anammox细菌为 0.05 mg N/L)。此外,虽然污水中的硝酸盐浓度逐渐积累(图2 A),但n-DAMO古菌的硝酸盐去除速率(rDA)的增加与HRT的缩短密切相关。具体而言,rDA从34.0 mg N/L/d(HRT为3.7 d)显著增加到97.3 mg N/L/d(HRT为1.0 d)(p < 0.01),表明n-DAMO古菌活性增强。在UASB的底部可以看到红色的颗粒(图3),而在三相分离器(MLVSS < 0.01 g/L)上方的液相中几乎没有检测到悬浮的生物质,表明两者之间的溺水分离效果良好。表2总结了anammox颗粒(第Ⅰ阶段结束时样品)和
anammox+n-DAMO
复合颗粒(第Ⅲ阶段结束时样品)的特性。运行170天以上后,MLVSS从13.1±0.5 g/L增加到15.6±0.6 g/L。MLVSS与MLSS的比率在0.7-0.的范围内,与其他研究的颗粒处于同一水平。在第Ⅰ阶段和第Ⅲ阶段结束时,颗粒的中值直径分别为0.7±0.2和0.7±0.1 mm,尺寸分布无明显变化(p> 0.05)。在实验结束时,直径大于0.6 mm的
anammox+n-DAMO
复合颗粒的百分占比约为80%以上。Anammox+n-DAMO复合颗粒的沉降能力方面,SVI5和SVI30分别确定为32±2和27±4 mL/g。此外SVI5与SVI30的比率在1.10-1.23之间,表明其具有良好的沉降能力。此外,anammox+n-DAMO颗粒的污泥比重确定为96±4 g VSSg VSS/L颗粒,与其他类型的颗粒相近(例如,anammox颗粒:91-120 g VSS/L颗粒,好氧颗粒:40-70 g VSS/L颗粒,厌氧颗粒:128-136 g VSS/L颗粒)。

图3 不同尺度下观察颗粒污泥的图像(A-C)和实验终止时颗粒的尺寸分布(D)。为了阐明微生物群落,首先对整个颗粒进行了16S rRNA基因扩增子高通量测序。结果显示第Ⅲ阶段优势门为Chloroflexi (25.3%)、Patescibacteria (20.8%)、Proteobacteria (13.6%)、Euryarchaeota (9.9%)、Planctomycetes (9.1%)、 Actinobacteriota (6.0%)、Armatimonadetes(4.3%)、Bacteroidota (3.1%)、Firmicutes (2.1%)、Acidobacteriota (2.0%) 以及NC10 (1.3%)。n-DAMO古菌和n-DAMO细菌均在颗粒中被发现。在获得颗粒中鉴定出的Candidatus ‘Methanoperedens’ (9.9%)隶属于Euryarchaeota phylum,被认为是硝酸盐型的厌氧甲烷氧化古菌。检测到的NC10门的所有序列都属于Candidatus ‘Methylomirabilis’,相对丰度为1.3%,已知该菌具有将亚硝酸盐还原与厌氧甲烷氧化耦合的能力。此外,隶属于Planctomycetes phylum的anammox细菌Candidatus ‘Brocadia’和Candidatus ‘Kuenenia’检出的相对丰度分别为1.7%和0.6%。值得注意的是,已表明微生物丰度与活性之间的相关性较弱。因此仅凭当前可用信息,很难将功能性微生物(anammox细菌,n-DAMO细菌和n-DAMO古菌)的活性与它们的丰度联系起来。除上述已知功能的微生物群体外,
Candidatus
‘Roizmanbacteria’ (16.4%)、Chloroflexi_SBR1031 (6.6%)、Anaerolineaceae_uncultured(4.7%) 以及SM1A02 (4.7%)等其他高丰度群体亦被检出。由于甲烷是唯一提供的碳源,因此这些无法识别的微生物的生长更可能依赖于细胞裂解所释放的有机碳或其他微生物所分泌的细胞外聚合物质(EPS)/氨基酸。例如,Candidatus ‘Roizmanbacteria’被保存在缺乏培养典型方式的superphylum candidate Parcubacteria中。最近的一项研究分析了该组中的12个单扩增基因组,显示了其多糖摄取和硝酸盐还原的呼吸能力。隶属于Chloroflexi门和Anaerolineaceae科的微生物通常相伴于n-DAMO和anammox培养物被检出。这些微生物群体被认为使用细胞裂解产生的有机碳进行生长并且在颗粒化进程中发挥作用。相似地,SMA1A02也通常在n-DAMO和anammox培养物中被检出,但其功能仍然有待研究。此外,研究通过将颗粒切成7层来研究颗粒径向上的微生物分层,并通过16S rRNA基因扩增子测序阐明了每一层的微生物群落(图4 B)。PCA散点图显示了内层(第1-6层)和外层(第7层)之间的清晰分隔(图4 C),说明微生物群落从颗粒表面到颗粒内层的差异。此外,热图(图4 D)显示了n-DAMO古菌、n-DAMO细菌和anammox细菌在不同层(第1层到第7层)的分布,证实了anammox细菌和n-DAMO古菌分别在外层和内层的优势。同时,仅在内层(第1-6层)检测到n-DAMO细菌,其在颗粒表面与厌氧氨氧化菌的竞争中已失去优势。研究通过冷冻切片-FISH的方法进一步验证了三种关键微生物群体的分布(图4 E和F)。将n-DAMO絮体与成熟的anammox颗粒混合后,n-DAMO细菌和n-DAMO古菌成功地附着在anammox颗粒的表面,并聚集在一起(图4 E)。大约4个月的富集后(图4 F),大多数n-DAMO微生物转移至颗粒的内侧,外层被anammox细菌包被,但仍可观察到少量在颗粒表面与anammox细菌紧密生长。通过FISH观察到的这种独特的微生物分层与冷冻切片法结合16S rRNA基因扩增子测序的结果一致(图4 B)。这种现象可能与这些微生物的动力学特征和底物的生物利用性有关。尤其地,由于液相基质中不提供硝酸盐,n-DAMO古菌可能不会在颗粒表面生长。此外,具有较高亚硝酸盐亲和力(0.05 mg N/L)的anammox细菌在亚硝酸盐竞争中可能会优于亚硝酸盐亲和力较低(0.1 mg N/L)的n-DAMO细菌。其次,n-DAMO微生物的生长速度非常慢,倍增时间超过数周。因此,具有较高剪切力的颗粒表面不利于这类缓慢生长的微生物生长,而颗粒的内层将起到保护作用以免生物质流失。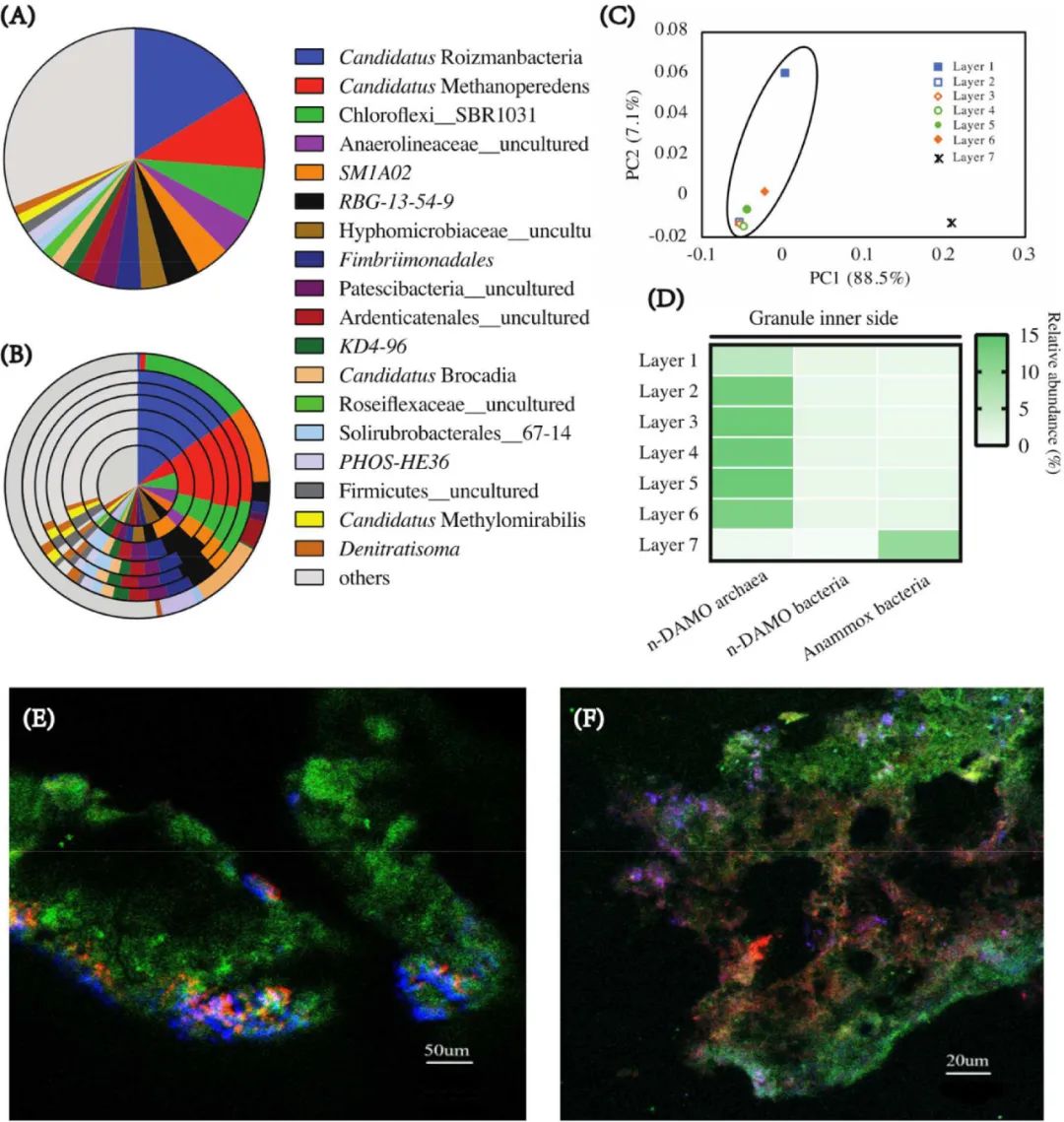
图4 第Ⅲ阶段稳态时的微生物群落(第Ⅲ阶段):由(A)全颗粒16S rRNA基因扩增子测序和(B)冷冻切片(颗粒7层)-16S rRNA基因扩增子测序揭示,图中列出相对丰度>1%的属。(C)7层微生物群落的PCA分析图(D)热图揭示主导微生物n-DAMO 古菌、n-DAMO 细菌和anammox细菌在颗粒表层和内部中的分布(第 1 层至第 7 层:从颗粒中心到表面)。(D)第Ⅱ阶段和(E)第Ⅲ阶段末期拍摄的颗粒的冷冻切片-FISH图像(绿色为Anammox细菌,蓝色为n-DAMO细菌,红色为n-DAMO古菌)。自2006年首次富集以来,n-DAMO微生物的研究已有十多年的历史。在最初的十年中,研究人员主要致力于阐明这些新微生物群体的代谢途径,并在自然和工程系统中检测它们的存在。在最近五年中,越来越多的研究开始将n-DAMO工艺用于污水和地下水处理。由于使用甲烷作为电子供体来还原亚硝酸盐/硝酸盐的独特优势,n-DAMO工艺已被认为同步脱氮及温室气体减排的良好选择。如表3中所总结的,不同的生物质类型(絮体、生物膜和颗粒)的n-DAMO微生物已被广泛富集。值得注意的是,由于易于操作,最初的富集通常是从絮状物开始。然而,悬浮的絮体在实际应用中具有很大的缺点,即沉降能力差。根据我们对本研究中使用的n-DAMO微生物絮体的测定,其SVI30高于200 mL/g,污泥沉降性能较差。为了避免生物质流失,具有悬浮生物质的反应器必须以SRT显著较长的反应器中序批式运行。但是,这些系统的MLVSS仍然很低(0.5-1.5 mg/L),从而限制了氮的去除。因此,悬浮的絮状污泥不适合n-DAMO工艺的实际应用。在n-DAMO微生物的最新应用中,生物膜系统是一种较为流行的配置。迄今为止,已在各种污水流中(例如生活污水(主流)和厌氧消化液(侧流))实现了n-DAMO工艺生物膜系统的演示。由于生物膜完全附着在膜上,因此理论上生物质不会因冲洗流失。与悬浮的絮状污泥相比,生物膜系统由于充分截留了生物量,实现了可实用的脱氮率(高达1 kg N/m3/d),这是生物膜系统的主要优势之一。然而,微生物活性高度依赖于生物膜的厚度。尽管薄的生物膜会由于生物量不足而导致脱氮效果不佳,但生物膜过厚会带来传质受限等问题。实际上,生物膜厚度的管理对MBfR的稳定运行至关重要。在实际操作中,合适的生物膜厚度的维持需要谨慎操作,例如增加剪切力/曝气力度以及化学试剂(表面活性剂)投加等。此外,MBfR中的中空纤维膜不仅用作生物膜生长载体,同时承担甲烷传质的作用。一旦长期运行后老化的纤维膜发生泄漏,则需要先剥离生物膜后再更换新的纤维。这种操作可能会损伤反应器的性能,也将消耗额外的时间进行生物膜的重新附着。与絮体相比,颗粒系统具有更高的沉降能力,SVI30仅为23±5 mL/g。因此,大多数生物质都可以留在反应器中,稳态下MLVSS浓度高达15.6±0.6 g/L。在脱氮速率与生物膜处于同一水平的情况下(表3),颗粒污泥具有一些独特的优势。首先,由于不需要塑料载体,颗粒系统的建设成本相对较低。其二,颗粒污泥更有利于收集、储存以及用于新反应器的接种。其三,中空纤维膜的替换在现存的UASB中更容易替换。由于UASB中的中空纤维膜仅用于甲烷传质而没有生物质附着,替换时无需顾虑其对整体性能的影响。基于上述优点,一项研究的结果表明,颗粒系统在高强度废水中的脱氮性能可实现TN去除速率为1.0 kgN/m3/d和TN去除率为94.8%的高水平,具有高强度废水脱氮的实用价值。表3 不同生物质类型(絮体、生物膜及颗粒)之间的比较
本研究开发了一种基于UASB的新技术,可将n-DAMO微生物快速耦合到anammox颗粒上。n-DAMO颗粒化在过去的研究中已被实现。例如,Fan等人(2019)在一年多的时间里从n-DAMO絮状污泥中获得了n-DAMO颗粒,并且研究了小型n-DAMO颗粒(< 200 μm)中甲烷传质的影响。与之前的研究相比,本研究提出了一种新的方法,可以在6个月内快速培养出大型anammox+n-DAMO颗粒(~700 μm)。以下是n-DAMO颗粒快速实现的两个关键因素。首先,以成熟的厌氧氨氧化颗粒用作生物载体,以支持附着在颗粒表面的n-DAMO微生物。通常地,颗粒/生物膜的形成包括三个步骤,即附着、小菌落形成和成熟。EPS对于污泥聚集(将自由活动的细胞聚集在一起)的过程具有重要意义。尽管已知anammox细菌比其他微生物(如活性污泥和反硝化污泥)产生的EPS多于其他微生物,但目前对古菌EPS产生的认识却非常有限。在先前的研究中,n-DAMO微生物颗粒化过程较长(> 1年)可能是由于n-DAMO微生物产生的EPS不足。本研究中使用成熟的anammox颗粒作为生物载体,这些颗粒表面已经具有足够的EPS。一旦悬浮态的n-DAMO微生物絮体被接种,这些微生物能够在EPS的协助下附于颗粒表面,因此有助于被颗粒包埋。通过观察证明,在II阶段的5-6周内液体变得澄清,n-DAMO微生物的絮体在相对较短的时间内固定在了生物载体(anammox颗粒)上。相似地,在anammox颗粒反应器中提到了类似的机制:其他anammox微颗粒(絮凝物)的聚集导致anammox颗粒的增大。一旦颗粒表面形成n-DAMO微生物的微生物菌落后,第二个关键则是避免这些新“移民”的分散。具体来说,高剪切力会导致这些新组合颗粒表面上的n-DAMO微生物脱离。因此,提供适度的条件使它们最终生长并成为颗粒的一部分至关重要。在这项研究中,我们通过逐步增加切向力来提高流速的策略。在连续进料的阶段III中,随着微生物活性的逐渐增强,升流速度从0.5至4.5 m/h逐步提高(图2 B)。经过4个月的运行后,新“移民”(n-DAMO细菌和n-DAMO古菌)移至颗粒内层(图4 D),表明anammox和n-DAMO组合颗粒已成熟。这项研究开发了一种实验室规模的UASB,将anammox细菌和n-DAMO微生物整合到颗粒污泥中,并实现了高强度合成废水的高水平氮去除。主要结论和结果如下:
1. 仅6个月内完成了anammox细菌和n-DAMO微生物耦合颗粒的形成;2. 使用成熟的anammox颗粒作为生物载体并逐步上调升流速度是快速获得anammox+ n-DAMO混合颗粒的两个关键;3. 获得了具有实用的脱氮性能的颗粒污泥体系(1.0 kgN/m3/d);4. 阐明了颗粒径向的微生物分层,显示了anammox细菌和n-DAMO古菌分别在外层和内层的优势;5. 与絮体相比,组合的anammox+ n-DAMO颗粒的良好沉降性是实现高水平脱氮性能的关键;6. 与生物膜相比,颗粒污泥具有更低投资成本、更稳健的性能以及更简易的污泥收集与储存等优点。





















 010-82736610
010-82736610
 股票代码: 872612
股票代码: 872612
 京公网安备 11010802020745号
京公网安备 11010802020745号










