绘制肝脏单细胞图谱开启肝脏疾病的精准治疗-解读Nature最新研究
原创作者介绍:Dr.李(炎症、代谢 、肿瘤基础研究)、肝胆医生蒋贝格(东方肝胆外科医院肝胆外科,博士,副教授,副主任医师。)
一.肝脏我们知多少
肝脏是消化系统中最大的消化腺,也是人体内脏里最大的器官,位于人体的腹部位置,在右侧横隔膜之下,胆囊的前端且在右边肾脏的前方及胃的上方。它不仅参与糖、脂类、蛋白质三大基本物质的代谢,还参与维生素的合成、分解和储存;核酸代谢;激素的生物转化以及胆红素和胆酸的代谢。肝脏还是人体内最大的解毒器官,体内产生的毒物、废物,吃进去的毒物和对肝脏有毒性的药物等必须通过肝脏解毒,以无害物质的形式分泌到胆汁或血液排出体外。另外,还有造血和凝血等作用[1]。
肝脏由无数大小、形态相似的肝小叶组成[1]。正常情况下,肝脏通过其组织内的成千上万的肝小叶完成其复杂的功能。肝小叶由肝细胞、毛细胆管及血管组成,呈多面棱柱状(图1)。肝小叶中央有一纵行的中央静脉,肝细胞以中央静脉为中心向四周略呈放射状排列形成肝细胞索(板)。肝细胞索中间为肝血窦,肝血窦腔内有枯否细胞(Kuffer cell)等淋巴细胞。相邻两肝细胞之间有胆小管。胆小管将肝细胞分泌的胆汁汇集至肝小叶周边的小叶间胆管内。
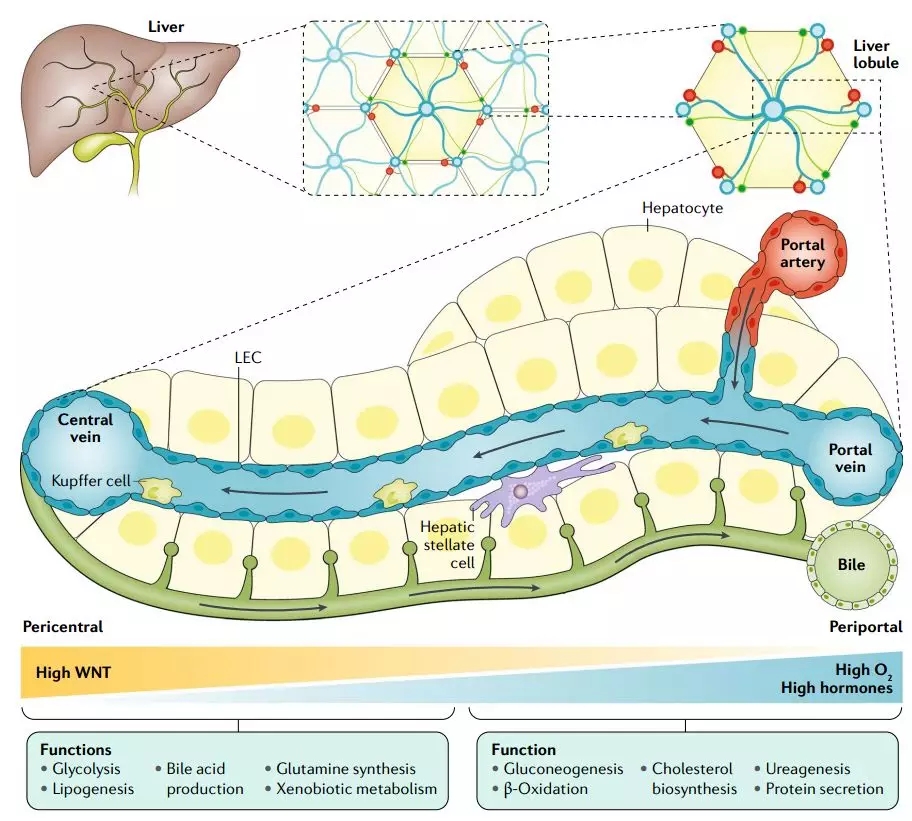
图1. 肝脏结构与主要功能。Central vein:中央静脉, Portal vein:门静脉, Pericentral:中心周围。Liver:肝脏,Liver lobule:肝小叶,Hepatocyte:肝脏细胞,Kuffer cell:枯否细胞,Hepatic stellate cell:肝星状细胞,Bile:胆汁。Glycolysis:糖酵解,Bile acid production:胆汁酸合成,Glutamine synthesis:谷氨酰胺合成,Lipogenesis:脂肪生成,Xenobiotic metabolism:外源物代谢,Gluconeogenesis:糖异生,Cholesterol biosythesis:胆固醇生物合成,Ureagenesis protein secretion:尿素生成,b-oxidation:脂肪酸氧化。(Nat Rev Gastroenterol Hepatol. 2019,16(7):395-410)
人肝约有25亿个肝细胞,5000个肝细胞组成一个肝小叶,因此人肝的肝小叶总数约有50万个。如此多的肝小叶是如何进行工作的?每个肝小叶中的相同类型的细胞功能相同吗?不同肝小叶中相同细胞具有相同的功能吗?另外一个值得一提的问题,肝脏是成年内脏中再生能力最强的一个器官,它有干细胞吗?或者它的干细胞在哪里?这些问题均是肝脏领域的研究难点与热点。
二.《Nature》绘制出人类第一张肝脏的单细胞图谱
最近《Nature》杂志上发表德国和法国的研究团队共同合作的成果。他们通过流式细胞仪技术分离获取正常肝组织的约1万个细胞,然后利用单细胞RNA 测序技术对上述分离的约1万个单细胞进行测序,高通量数据分析整合,绘制出第一张人类肝脏单细胞图谱[2]
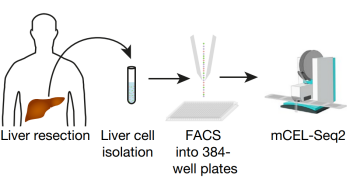
图2. 对人肝细胞进行scRNA-seq的研究方案。从肝切除标本消化,制备单细胞悬浮液,流式细胞仪分选,然后进行sc-RNA测序分析。(Nature. 2019, 572(7768):199-204.)
这张肝脏单胞图谱绘制了所有重要的肝细胞类型:包括肝细胞、胆管上皮细胞、肝上皮祖细胞、血管内皮细胞、肝内巨噬细胞以及其他免疫细胞类型等。发现许多新的肝脏细胞亚群,如以前未知的内皮细胞、枯否细胞(Kupffer cell)和肝细胞亚型。该研究发现过去认为细胞类型相同的单个细胞可能存在惊人的“多样性”,这些亚型虽然在形态上几乎没有差异,但是它们之间的基因表达谱是“千差万别”的。而正是由于这些基因表达谱的不同决定了以往认为同一类型的细胞存在不同的功能与命运。譬如通过该方法发现EPCAM+ (epithelial cell adhesion molecule) 表达阳性的细胞是异质的。肝脏是唯一可以再生的器官。在剩下大约25%的肝脏是还可以再生成为一个全肝。什么细胞参与了肝脏的再生?有研究发现可能是EPCAM(epithelial cell adhesion molecule) 表达阳性的细胞(EPCAM+细胞)参与肝脏的再生。为了寻找真正的肝脏干细胞,对来自成人肝脏的单个EPCAM+细胞进行了测序。通过分析发现EPCAM+细胞可以分成ASGR1+的肝细胞偏向型的细胞群,KRT19highCFTRhighALBlow的胆管细胞群和具有形成肝细胞、胆管细胞潜能的祖细胞群(图3)。上述结果表明在RNA转录水平上EPCAM+细胞是异质的。

图3. 成人肝脏中的干细胞群鉴定。(Nature. 2019, 572(7768):199-204.)
总之,通过实验和计算单细胞分析方法让科学家能够以高分辨率检测分析某个组织中的单个细胞,能分辨、捕捉到细胞类型和细胞状态的“多样性”,以了解它们在发育过程中或疾病进展中的微妙变化[2,3]。
三.精准绘制开启精准肝病治疗
1.肝脏疾病的危害
肝脏疾病是一种常见的危害性极大的疾病,是世界范围内疾病和死亡的主要原因。在正常情况下,肝脏各种功能有条不紊地进行着,当肝脏受到各种致病因素侵袭时,其功能状态和组织结构必然受到影响。常见的肝脏疾病包括乙型肝炎病毒(HBV, hepatitis B virus)和丙型肝炎病毒(HCV, hepatitis C virus )感染、酒精性肝病(ALD,alcoholic liver disease)和非酒精性脂肪性肝病(NAFLD,nonalcoholic fatty liver disease)及相关肝硬化、肝衰竭(LF, liver failure)和肝细胞癌(HCC,hepatocellular carcinoma )。
在中国,肝病影响了大约3亿人,从而对全球肝病负担产生了重大影响。20世纪90年代初,中国实施了大规模的免疫接种计划和强制性的丙型肝炎病毒输血筛查,在很大程度上分别预防了新的乙型肝炎病毒和丙型肝炎病毒感染。然而,由于人们生活方式的改变,ALD和NAFLD患者的数量急剧增加。近年来,HBV和HCV相关的终末期肝病,如肝硬化、慢性LF和HCC,有所增加,是导致中国肝脏疾病的高死亡率的主要原因[4]。Nadim Aizarani等绘制的首张人类的肝脏单细胞图谱,将会我们提高对上述肝脏疾病的理解[2]。以下,我们以肝癌为例探讨单细胞测序的意义。
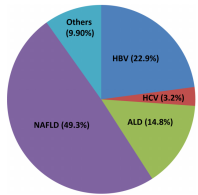
图4.各种肝脏疾病在中国发病率。(Hepatology. 2014,60(6):2099-2108.)
2.单细胞测序技术提高肝癌防治的精确度
作为一种世界范围内常见的恶性肿瘤,原发性肝细胞癌(Hepatocellular carcinoma,HCC)的死亡率在所有恶性肿瘤中居第三位[4]。全世界半数左右的肝癌病人集中在中国,占我国恶性肿瘤死亡率的第二位[4]。肝癌的临床诊疗中仍存在着诸多亟待解决的问题,譬如,早期诊断难,大多数HCC 患者确诊时一般已是中晚期;复发后转移率高;有效治疗靶点缺乏等。
2017年发表在《Cell》杂志的一篇文章报道发现肝癌基因组的异质性超乎想象,这对于肝癌的早期诊断及精准化治疗无疑是一巨大挑战。目前通过高通量测序技术分析疾病组织与正常组织的基因表达谱的技术层出不穷,但是由于检测的灵敏度、数据分析的能力等问题只提供了整个组织样本中多个细胞中某个功能基因浓度的平均值,因此这样的高通量测序手段的精确度有待进一步提高。众所周知,肿瘤细胞特别是肿瘤干细胞可能就是数量极少但是“生命力”特别顽强的细胞,但是由于目前测得的数据是肿瘤分子分布的平均情况,因此,我们很难真正找到其决定作用的肿瘤干细胞。那么,通过精准地绘制肝脏细胞图谱和肝癌细胞的图谱找出它们之间的差异,然后针对它们的差异制定特异性的治疗策略,这肯定能够提高肝癌的个性化治疗。另外,假如能够在肝癌发生前就能通过基因转录水平上的分析获知某潜在患者的患肝癌的几率,这个对于肝癌的防治将是一大进步。
正如绘制首张人类肝脏单细胞图谱工作的通讯作者Dominic Grün所说,“稀有细胞类型甚至单个细胞的贡献在这个平均值中都丢失了。但可能正是这些细胞决定了一个组织是健康的还是患癌症的。”科学家们通过单细胞测序捕获被检查样本中每个健康或患病细胞的分子特性,再与来自健康组织的参考数据进行比较,才能找到靶向肿瘤细胞的特异分子,制定更加特异的治疗方案。利用单细胞测序技术研究癌症将有助于提高诊断水平,最终进一步提高肿瘤的治疗水平[3]。
首张人类肝脏的细胞图谱将是肝癌研究的重要参考数据库,提供了一份客观的“对照”。通过比较正常肝脏细胞以及肝癌细胞,科学家们可能找到了更多、更特异的肝癌的肿瘤标志物。如果能在体检中对肝细胞进行单细胞测序,或许就能在早期发现肝癌的倾向,将肝癌的诊断提前,从而真正实现早诊断早治疗。总之,单细胞测序技术在癌症中的应用,能帮助提高癌症的诊断,对肿瘤的防治具有重大意义。
四.单细胞测序技术离临床应用有多远?
单细胞测序技术给我们带来“高分辨率”、“高精度”的细胞信息,那么它离临床应用有多远:
(1) 首先,这个单细胞测序的结果正确率怎么?
(2) 单细胞测序数据分析结果的可靠性怎么样?
(3) 单细胞测序的成本有多高?
五.总结
综合来看,通过绘制肝脏单细胞图谱,让我们从单细胞水平更为精准地理解肝脏在自然发育,或是疾病发展中所呈现的“细微”变化;该技术是研究肝脏生理学和肝脏疾病的绝佳工具,将进一步推进相关研究,从而有望在未来研制出更好的肝脏疾病诊断和治疗的方案/策略,减少甚至消灭某些肝脏疾病提高我们的健康水平。
参考文献
1. Ben-Moshe S, Itzkovitz S. Spatial heterogeneity in the mammalian liver. Nat Rev Gastroenterol Hepatol. 2019,16(7):395-410.
2. Aizarani N, Saviano A, Sagar, Mailly L, Durand S, Herman JS, Pessaux P, Baumert TF, Grün D. A human liver cell atlas reveals heterogeneity and epithelial progenitors. Nature. 2019, 572(7768):199-204.
3. Ray K. Mapping the cells in the liver - unchartered subtypes and heterogeneity. Nat Rev Gastroenterol Hepatol. 2019. [Epub ahead of print]
4. Wang FS, Fan JG, Zhang Z, Gao B, Wang HY. The global burden of liver disease: the major impact of China. Hepatology. 2014;60(6):2099-2108.
5. Cancer Genome Atlas Research Network. Comprehensive and Integrative Genomic Characterization of Hepatocellular Carcinoma. Cell. 2017, 169(7):1327-1341
本文首发:肝胆柳叶刀
不感兴趣
看过了
取消
不感兴趣
看过了
取消
精彩评论
相关阅读





 打赏
打赏


















 010-82736610
010-82736610
 股票代码: 872612
股票代码: 872612




 京公网安备 11010802020745号
京公网安备 11010802020745号
