
静脉动脉体外膜肺氧合(VA-ECMO)和经皮微轴左心室辅助装置(pLVAD)或“EC-VAD”;联合应用已被报道用于进行左心减压。我们对2011年2月至2014年10月期间接受EC-VAD(n = 29)或仅接受VA-ECMO(仅ECMO; n = 196)治疗难治性心源性休克的患者进行了回顾性研究.14名患者先接受了VA-ECMO治疗和然后使用Impella泵 pLVAD(E→EC-VAD),另外15名患者先接受Impella泵,然后VA-ECMO(I→EC-VAD)。结果显示EC-VAD植入24小时后E→EC-VAD患者肺动脉收缩压降低(36.00±16.84 mm Hg对比30.63±12.13 mm Hg; p = 0.049)和舒张压降低(24.25±13.45 mm Hg对比17.25±7.96 mm Hg,p= 0.049)。在同一时期,I→EC-VAD患者表现出改善SvO2(43.14±16.75%对75.18±13.88%,p = 0.043)和PaO2 / FiO2比值(148.55±67.69 mm Hg对比374.51±170.97 mm Hg,p = 0.043 )。E→EC-VAD的30天存活率为42.9%,I→EC-VAD的存活率为46.7%,仅ECMO的存活率为49.0%(p = 0.913)。EC-VAD患者的溶血发生率更高(44.83%,仅接受ECMO 组17.35%,p = 0.002); 然而,其他不良事件的发生率并未增加,包括出血和下肢缺血。在难治性心源性休克中,尽管溶血增加,但VA-ECMO和pLVAD联合使用可改善或避免难治性心源性休克时的左心室扩张,同时促进足够的血流量。
关键词:机械循环装置,心衰
急性心脏衰竭最严重的情况是心源性休克,当发生合并急性心肌梗死时,死亡率高达50%。
由于VA-ECMO显著的心肺支持和快速响应,它可被用作心源性休克的急性治疗。然而,VA- ECMO会产生不良反应:诸如出血、肢体缺血和感染。此外,逆行主动脉VA-ECMO会增加左心室的后负荷,导致左心室扩张,这是之前VA-ECMO未被发现和报道的并发症,其临床表现为肺水肿、室性心律失常和心肌缺血症状。针对左心室减压,一些建议已经被提出,包括主动脉内球囊反搏,球囊房间隔造口术,和额外的插管插入肺动脉、左心房或左心室。然而,这些建议都不能完全对左心室减压,甚至使急性机械循环支持复杂化。
在这种情况下,通过经皮穿刺左室辅助装置(pLVAD)的应用最近被认为是VA-ECMO左室减压的一种可行的方法。这个经皮微轴流式泵位于主动脉瓣对面,将血液从左心室抽出并排入主动脉。通过这种机制,pLVAD已被证实可以降低左心室后负荷,表现为肺毛细血管楔压、肺水肿和左心室舒张末期直径的减少。然而,在VA-ECMO中使用经皮左心室辅助器械进行左心室减压的研究仅限于病例报告和结果不一致的小病例研究。随着更多的此类装置在导管室中被使用,将VA-ECMO添加到正在进行的pLVAD中逐渐成为一种治疗模式 。这样的策略可以改善缺氧、右心衰和全身血液流动,但是在这方面的组合疗法的研究却很少。
在难治性心源性休克(RCS)的背景下,本研究检查了我们同时使用VA-ECMO和Impella经皮左心室辅助装置(EC-VAD)进行左心室减压(通过将Impella泵加入VA-ECMO)以及管理全身血流量不足和缺氧的经验。
Materials and Methods
工具和方法
Patient Population, Data Abstraction, and Outcomes of Interest
患者人群,数据抽象和感兴趣的结果
哥伦比亚大学机构审查委员会批准了这项研究。本研究回顾性地分析了2010年1月至2014年10月期间接受VA-ECMO和Impella轴向血泵治疗的29例RCS患者。受试者根据他们心源性休克后是否首次接受VA-ECMO(E→EC-VAD组,n = 14)或Impella泵(I→EC-VAD组,n = 15)进行分组。使用Impella模型CP(n = 8)或模型LP 2.5(n = 21)。提取的回顾性数据包括以下内容:患者人口统计学,心源性休克的病因学,血液动力学和其他临床变量(例如,全血细胞计数,电解质),不良事件和存活。 在基线时,第一个装置(VA-ECMO或Impella)的机械循环支持装置单一疗法后立即收集变量的可用记录,并且在组合装置治疗开始之前,之后和之后24小时立即收集数据(EC-VAD)。 在该时间段内仅接受VA-ECMO用于RCS的患者(仅ECMO组,n = 196)作为对照组。 感兴趣的重点是EC-VAD后,30天存活率以及不良事件的血液动力学变化。

定义
心源性休克的定义在文献中有所不同。 本研究使用了之前报道的RCS定义:
1)收缩压小于90 mm Hg,心脏指数小于2.0 L /(min·m2),肺毛细血管楔压超过16 mm Hg(或没有肺动脉导管和终末器官衰竭的证据时肺水肿的证据),或者2)尽管进行了最大限度的药物干预和/或IABP,仍无法通过心肺转流术进行治疗.对于VA-ECMO / Impella泵植入时接受胸外按压的患者(1个 I→EC-VAD患者和40 个仅ECMO的患者),指定收缩压为60 mm Hg,舒张压为20 mm Hg(平均动脉压33 mm Hg)。 根据先前的研究,选择这些值已经足够来表示胸部按压的血液动力学。
RCS的病因分类为心脏切开术休克,急性心肌梗死,原位心脏移植后的移植物功能障碍,急性失代偿性心力衰竭或其他。血管活性肌力评分用于评估药理学用途(血管活性变力性评分=多巴胺+多巴酚丁胺+米力农×10 +肾上腺素×100 +去甲肾上腺素×100(均以μg/ kg / min计)+加压素(单位/ kg / min)× 10000).心肌恢复定义为断开机械循环支持装置治疗,出院后或外植体后30天的生存能力。在适当的情况下,我们根据机械辅助循环支持机构的描述来定义不良事件.在本研究中,溶血的定义来自机械辅助循环支持机构间注册机构对轻微溶血的定义:设备植入后血清乳酸脱氢酶(LDH)大于植入中心正常范围上限的2.5倍(我们中心的正常LDH范围:115-221 u / l),为了排除继发于肝功能不全的LDH升高,定义还要求AST和ALT水平升高超过其正常范围的三倍(AST正常范围,12-38; ALT正常范围,7-41)。
Algorithm for MCS Therapy in Cardiogenic Shock
心源性休克MCS治疗算法
该机构的RCS评估和管理算法已在其他地方报道过。 简单来说,当患者确诊患有心源性休克时,激活休克团队快速评估患者的状况, 如有需要,短期心室辅助装置CentriMag泵(Thoratec,Corp,Pleasanton,CA)或VA-ECMO迅速插入作为更耐用的装置或心肌恢复的桥梁。

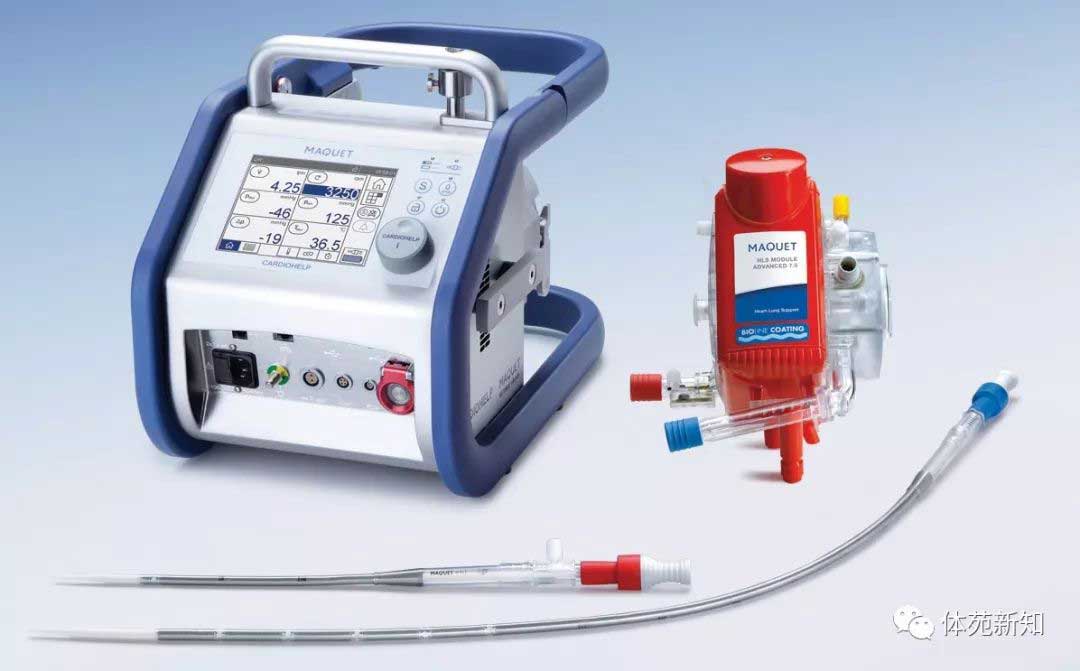
VA-ECMO通常用于RCS患者,这些患者情况不稳定而无法送到手术室,神经系统状态未知,或有严重的凝血功能障碍.,根据患者的临床状况和手术的紧急情况,决定VA -ECMO在床边,导管室或者手术室放置。VA-ECMO回路由Quadrox iD氧合器(Maquet,Wayne,NJ),Rotaflow离心泵(Maquet,Wayne,NJ)和SMART涂层管(Sorin,Italy)组成。 在可行的情况下,优选使用小动脉插管(15Fr-17Fr)通过股动脉入路对VA-ECMO进行外周插管。
基本上,根据患者在导管室中的状态,操作员自行决定连接决策,是使用Impella LP 2.5或CP System(Abiomed,Denvers,MA)代替CentriMag 或 VA-ECMO。 在荧光透视引导下,该装置最常通过股动脉入路经皮植入。 关于联合VA-ECMO和Impella轴向血泵植入的更多细节有其他的报道。
Statistical Analysis
统计分析
连续变量表示为平均值±1标准偏差。 分类变量表示为比例和绝对数字。 非正态分布变量表示为中位数和四分位数间距(IQRs)。 使用Fischer对分类变量的精确检验检测到差异。 Wilcoxon符号秩检验和Wilcoxon秩和检验分别用于非参数变量的组内和组间分析。 为了解决缺失的数据,对患者进行成对排除以进行个体分析。 p值<0.05被认为是统计学上有显着意义的。 所有p值都是双尾测试的结果。 使用StataSE版本13(StataCorp,LP College Station,TX)进行分析。
Results
结论
Addition of Impella pLVAD to VA-ECMO (E→EC-VAD)
为VA-ECMO增加Impella pLVAD((E→EC-VAD))
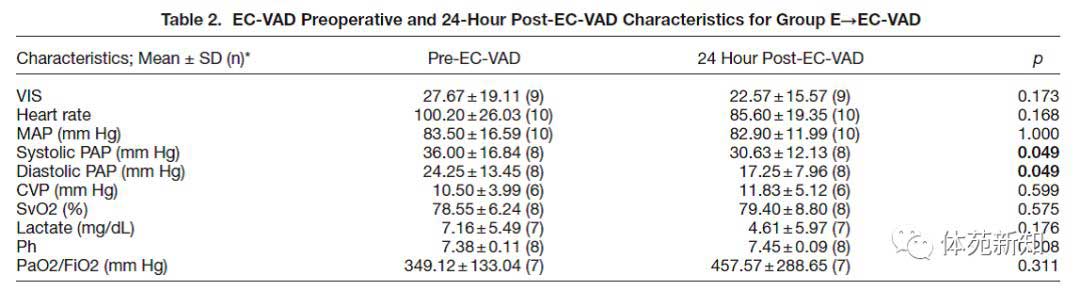
在29次EC-VAD试验中,对接受正在进行的VA-ECMO治疗的14名患者添加Impella泵,中位间隔12小时(IQR,4-26),适用于以下适应症:肺水肿和/或缺氧(n = 7),左心室内血液停滞(n = 5),顽固性室性心律失常(n = 2)。患者术前特征总结在表1中。总结研究中的所有患者,平均年龄为57岁(IQR,46-67),69.3%的患者为男性;这些变量在各组之间没有显着差异。与仅ECMO组相比,E→EC-VAD(n = 10,71.43%)中冠状动脉病变显着更为普遍(n = 81,41.33%,p = 0.047)。 E→EC-VAD组(n = 8,57.14%)的糖尿病患病率也高于仅ECMO组(n = 51,26.02%,p = 0.026)。继发于急性失代偿性心力衰竭的RCS发生率在E→EC-VAD组(n = 5,35.71%)中也高于仅ECMO组(n = 22,11.22%,p = 0.017)。 E→EC-VAD组内分析EC-VAD开始前和开始后24小时血流动力学和实验室值的差异总结在表2中。在EC-VAD植入24小时后,E→EC-VAD患者肺动脉压显着降低:收缩压(术前36.00±16.84 mm Hg较术后24小时30.63±12.13 mm Hg,p = 0.049)和舒张压(术前24.25±13.45 mm Hg较术后24小时,17.25±7.96 mm Hg,p = 0.049)。E→EC-VAD患者在EC-VAD治疗前显示出的高血管活性-变力性评分在术后24小时也降低了(之前27.67±19.11 mm Hg较治疗后22.57±15.57 mm Hg,p = 0.173)。

Addition of VA-ECMO to Impella pLVAD
为Impella pLVAD 增加VA-ECMO
对接受正在进行的Impella轴式血泵治疗的15名患者增加进行VA-ECMO治疗,治疗时间的中位数为7小时(IQR,3-31),以获得更多的心输出量(10)和心脏停搏(5)。
I→EC-VAD术前特征与仅接受ECMO治疗患者的比较见表1。 尽管心脏术后休克是在仅接受ECMO治疗组中最常见的RCS病因(n = 80,40.82%),但没有I→EC-VAD患者在心脏术后因休克而发生RCS(p = 0.001)。 相反,与仅接受ECMO治疗组相比,I组→EC-VAD(n = 11,73.33%)发生继发于急性心肌梗死的RCS发生率更高(n = 42,21.43%,p <0.001)。

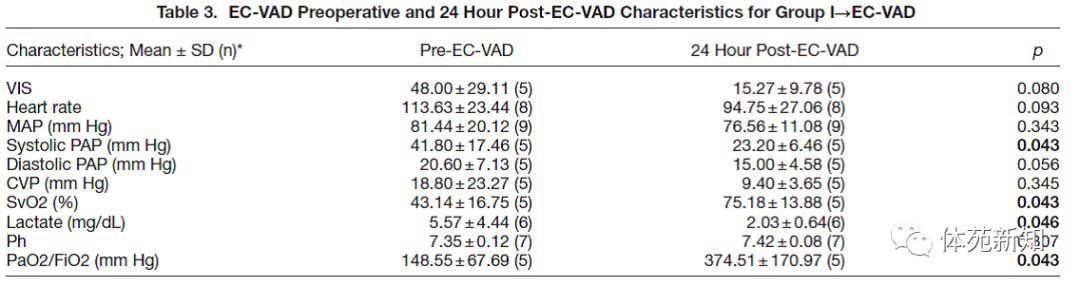
EC-VAD植入前后I→EC-VAD血流动力学的内部组分析也显示肺动脉收缩期压(术前41.80±17.46 mmHg较24小时后23.20±6.46 mmHg,p = 0.043)和舒张期压降低(术前20.60 ±7.13 mmHg较24小时后15.00±4.58 mmHg,p = 0.056)(见表3)。同样,I组-EC-VAD显示EC-VAD治疗开始后的血管活性-变力性评分减低(之前48±29.11 mmHg较24小时后15.27±9.78 mmHg, P=0.080)。I-EC-VAD组动脉血氧分压与吸氧分数(PaO2/FiO2)比值明显改善(之前148.55±67.69mmHg,较24小时后374.51±170.97 mmHg, p=0.043)。I_EC-VAD患者在EC-VAD植入后24小时内混合静脉血氧饱和度(SvO2)也显著增加(术前43.14±16.75%较24小时后75.18±13.88%,p=0.043),乳酸显著降低(术前5.57±4.44mg/dL较24小时后2.03±0.64mg/dL,p=0.046)。
Comparison of EC-VAD and ECMO-Only Hemodynamics
EC-VAD与ECMO血流动力学的比较
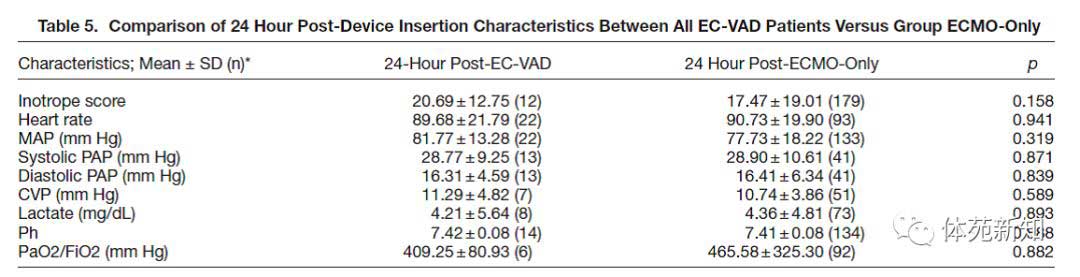
表4和表5中,所有EC-VAD患者在植入任何辅助装置前和ECVAD运转的前24小时进行基线血流动力学的组间分析,并与仅ECMO组进行比较。在基线时,与EC-VAD患者相比,仅ECMO患者的平均动脉压较低(EC-VAD71.70±16.39 mm Hg较仅ECMO,60.11±22.80 mm Hg,p = 0.012)(表4)。 EC-VAD和仅ECMO患者之间的其他基线血流动力学没有统计学意义(表4)。 同样,在EC-VAD或ECMO治疗24小时后,EC-VAD患者和仅ECMO患者之间没有观察到血流动力学(包括肺毛细血管楔压和PaO2 / FiO2)有显著的统计学差异(表5)。因为在基线以及ECMO介入后24小时(仅196名患者中的7名),仅ECMO治疗的患者可获得的SvO2数据非常有限,所以SvO2被排除在该分析之外。
Outcomes of EC-VAD Therapy
EC-VAD治疗的结果
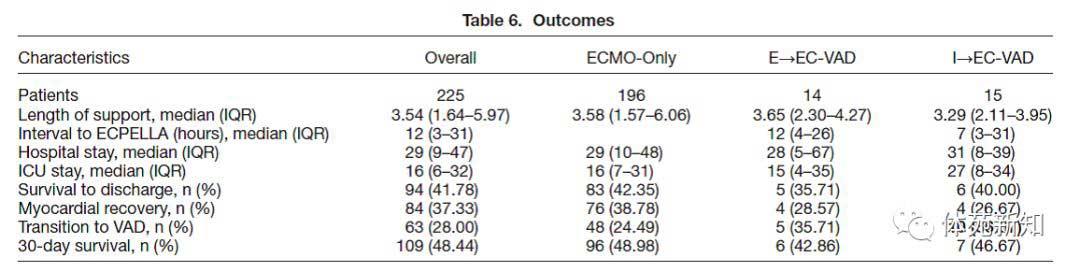
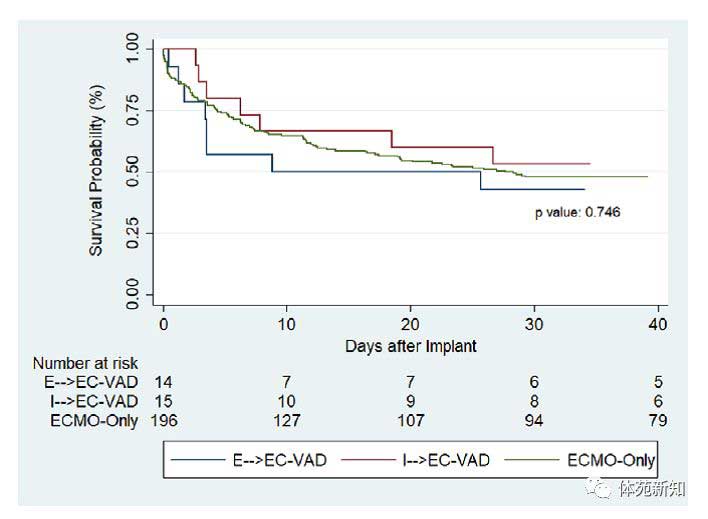
表6总结了EC-VAD亚组与仅ECMO组比较的总体结果。仅ECMO组30天存活率为49%,I→EC-VAD组为47%,E→EC-VAD组为43%(p = 0.913)。 各组的出院生存率相似(E→EC-VAD为36%,I→EC-VAD为40%,ECMO为42%,p = 0.911)。 在Kaplan-Meier生存分析中,E→EC-VAD患者似乎存在早期死亡(图1); 然而,三组的30天存活率相似(p = 0.746)。

EC-VAD患者的心肌恢复较少(E→EC-VAD为29%,I→EC-VAD为27%,仅ECMO组为39%,p = 0.555)。 与仅ECMO组相比,在I→EC-VAD(n = 10,67%)组中转变为VAD更常见(n = 48,24.49%,p = 0.001)。
无论哪个治疗组,大多数患者的辅助装置支持时间为3到4天,平均住院时间约为29天。 与仅ECMO(16天; IQR,6-32)相比,I→EC-VAD组(27天; IQR,8-34)的在ICU治疗的平均时间更长,但这没有统计学意义(p = 0.931)。 在仅ECMO组和E→EC-VAD组之间ICU停留时间也没有显著统计学差异。
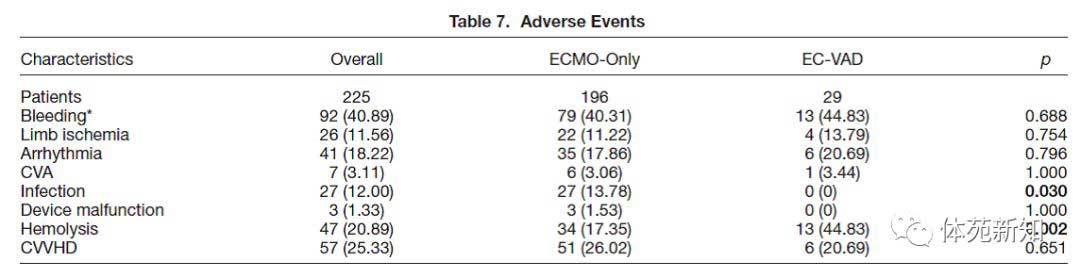
将所有EC-VAD患者与仅ECMO组的患者比较后,我们总结了不良事件(见表7)。 溶血在EC-VAD患者中更常见(44.83%对比17.35%,p = 0.002),但由于转氨酶升高,4名EC-VAD和17名仅ECMO组的患者被排除在分析之外。 没有EC-VAD患者在EC-VAD植入后发生感染,而仅14%的仅ECMO组患者并发感染(p = 0.030)。 其他不良事件发生率(包括出血,肢体缺血,心律失常或肾脏替代治疗的需要),在仅ECMO组和EC-VAD患者之间不存在统计学差异。
Discussion
讨论
本研究评估了RCS患者联合使用VA-ECMO和经皮左心室辅助装置的可行性。通过在相对较多患者中运用该方法的描述,有助于增长目前关于该主题为数不多的的报道。 本研究根据在Impella泵治疗中增加VA-ECMO的适应症对该疗法进行了独特的研究,反之亦然。 本研究的主要结果是,向VA-ECMO中加入Impella可降低肺动脉压,向Impella泵增加VA-ECMO,则显示可降低患者肺动脉压和改善SvO2。 EC-VAD和仅接受ECMO治疗患者的存活率在该研究中也具有可比性,并且EC-VAD治疗除了溶血外没有显着增加其他不良事件。
尽管有一些深入研究是关于RCS的单一的机械循环支持装置疗法,但涉及联合装置疗法的研究很少。 此外,关于联合ECMO-Impella泵治疗的病例报告和系列报告侧重于评估将Impella泵增加在VA-ECMO治疗中以进行左心室通气。然而,在导管室伴随血液动力学不稳定,和/或高风险的复杂冠状动脉解剖情况下,使用impella支持经皮冠状动脉介入数量的增加,我们意识到EC-VAD支持与装置插入反向顺序的建立。
如本研究所示,这两个队列在人口统计学和对EC-VAD治疗的反应方面存在显着差异。

Adding Impella to VA-ECMO
在VA-ECMO治疗中加入Impella
我们最近发表了VA-ECMO支持期间LV扩张的发生率和临床意义。之前的研究已经开始使用Impella泵作为一种可行的经皮选择,用于治疗继发于ECMO引起的心源性休克患者后负荷增加的左心室扩张。存在治疗左心室扩张的其他选择,例如经皮房间隔造口术,或增加左心房或左心室插管的中央VA-ECMO插管。这些策略并非没有缺点。通过插入左心房或左心室通气插管进行手术为左心减压具有高出血风险。简单的球囊造口术矿业在最初充分左心减压,但缺陷是易于自发闭合。心房支架术可能有助于避免这种情况,但由于房间隔比较薄,且不稳定,容易和相邻结构撞击,增加了错位的风险.
这项研究显示出与先前报道的一例类似的结果,该例为成人VA-ECMO患者经皮置入Impella模型LP 2.5进行了有效的左心室减压。同样,对E-EC-VAD患者在植入EC-VAD前后立即进行的分析表明,24小时肺动脉压降低,提示在生理学上Impella pLVAD 对VA-ECMO进行了有效的左心室减压(表2)。E→EC-VAD和仅ECMO组患者生存率相当,尽管前一组在单独使用VA-ECMO时出现明显的并发症,如左心室血液停滞和肺水肿。而在一些具有挑战性的RCS案例中,也支持EC-VAD的治疗可以维持生存的假设。

Adding VA-ECMO to Impella
在Impella中加入VA-ECMO
曾有报道在VA-ECMO中加入impella泵不仅可以减轻左心室扩张,而且可以增加心输出量和组织灌注。然而,这种循环增强的改善是否是由impella泵提供的直接结果尚不清楚。一种假设是,在向VA-ECMO增加Impella后,组织改善的增加可能反映了主要由VA-ECMO驱动的延迟灌注改善。在I→EC-VAD组中,EC-VAD支持显著改善血液动力学和氧合。这一发现表明,仅单独的pLVAD(2.5 LP Impella或CP模型)可能无法为严重的心源性休克患者提供足够的血流量,或着本组患者的心源性休克在右心室衰竭中占的比例更大无法由Impella pLVAD很好地支持。话虽如此,鉴于15例接受Impella泵治疗的患者中有11例首次出现心源性休克并发急性心肌梗死,后一种解释不太可能(在急性心肌梗死病例中,左主干或左前降支严重闭塞均可见左心衰)

EC-VAD Versus ECMO-Only Hemodynamics
EC-VAD与仅ECMO的血流动力学相比
值得注意的是,除了基线平均动脉压的差异,在基线和各自的装置开始治疗后EC-VAD患者和仅ECMO组的血流动力学在统计上没有显著差异。虽然队列太小而无法进行倾向性评分匹配,但结果表明,对于已经接受单ECMO治疗并在临床上无明显的左心室扩张和/或后遗症的患者来说,仅将VA-ECMO与经皮心室辅助装置结合可能并没有益处。
EC-VAD as a Therapy
EC-VAD作为治疗手段
本研究表明EC-VAD和仅ECMO组患者的30天死亡率、住院时间和ICU住院时间具有可比性。然而,EC-VAD患者的数量太少,无法进行更严格的结果分析。
不赞成这种联合循环支持装置用于左心室减压的一个担心是,这种装置导致的不良反应(出血、感染、溶血等)的可能风险随着同时操作多个设备而增加。特别是,多设备机械故障的风险是值得关注的,因为它们被认为会使患者的循环框架复杂化。 然而,在本病例系列中,EC-VAD和仅ECMO组患者之间的许多不良反应的发生率相似。一个重要的例外是ECVAD增加溶血。其理论意义在于,同时使用两种能够单独引起溶血的装置将恶化该事件的发生。然而,我们没有观察到在EC-VAD组群中需要连续静脉-静脉血液透析的显著增加。因此,这些发现表明EC-VAD是RCS治疗中可行的设备治疗方法。

Limitations
局限性
本研究有几个局限性。最明显的是分析的统计能力,在给出的29名EC-VAD患者研究组群中,因为它们只反映了EC-VAD患者的一个亚群,某些血液动力学和实验室结果尤其不被重视。由于缺乏常规的肺小动脉楔压和超声心动图数据的收集工作,诸如在添加pLVAD后左心室舒张末期尺寸的变化这类数据,对左心室扩张的分析尤其受到限制。
在本研究中溶血的临床意义尚不清楚,因为数据收集是回顾性的,所以无法调查溶血的临床表现,如尿变色、溶血引起的肾功能障碍等。缺乏常规的血浆游离血红蛋白或接触珠蛋白检测进一步限制了该研究对这个队列溶血严重程度的分析。本队列中也没有进行常规基线LDH检测,这可能会导致高估因设备治疗导致的溶血。
因为某些不良事件没有被准确记录,该研究在已知并发症方面也受到限制,比如评估Impella泵移位和Impola泵治疗的错位。由于缺少只针对Impella的组群,因此无法对单独使用Impella泵在RCS治疗中的疗效进行更深入地分析。重要的是,这项研究没有进行成本分析,而且这种综合疗法肯定会因为其高昂的费用而受到批评。最后,该研究受到选择偏差和其他回顾性分析的固有局限性的限制。

Conclusions
结论
VA-ECMO联合经皮左心室辅助装置是一种可行的治疗方案。此外,在患者的Impella泵上增加ECOM除了可以提供有效的组织灌注和心输出量的增加及改善氧合以外,也可以防止单一使用ECMO的左心室扩张。在这种联合疗法中,不良事件的发生率没有显著增加;但是,轻微溶血的风险仍然需要关注。目前该研究展示了联合治疗的可行性、安全性和有效性。为了证实这些发现并确定EC-VAD治疗作用,有必要进行更大规模的前瞻性研究。
文章来源于体苑新知
不感兴趣
看过了
取消

人点赞

人收藏

打赏
不感兴趣
看过了
取消






您已认证成功,可享专属会员优惠,买1年送3个月!
开通会员,资料、课程、直播、报告等海量内容免费看!

打赏金额
认可我就打赏我~
1元 5元 10元 20元 50元 其它
打赏作者
认可我就打赏我~
扫描二维码
立即打赏给Ta吧!
温馨提示:仅支持微信支付!
已收到您的咨询诉求 我们会尽快联系您
