


人人都能学懂CAR-T(十)|CAR-T细胞全球研发概况及中美对比分析
伴随着第4代CAR-T细胞的上市,我们不难看出,CAR-T细胞免疫疗法领域仍在蒸蒸日上。
上一期,我们介绍了“基于ClinicalTrials.gov数据库分析的CAR-T细胞治疗临床试验概览”,不难看出,全球正在开展的CAR-免疫细胞临床试验的国家众多,在肿瘤细胞免疫治疗领域,中国大陆以“465个临床试验”位居首位,美国紧随其后(图1)。
事实上,与美国CAR-T细胞疗法商业化已经形成相对成熟的模式不同,在中国,至今未有批准上市的商用CAR-T疗法。其次,中国在整个基因/细胞相关治疗领域,除了早期上市的今又生和安科瑞之外,目前仅有一款基因治疗药物 Spinraza(一款来自Biogen公司的ASO药物)获批上市。因此,国内在细胞免疫疗法方面的研发及商业化经验都是相对欠缺的。

图1:截止2021年2月25日,全球共有948项CAR-T细胞免疫疗法(适应症:肿瘤)的相关临床试验(数据来源:clinicaltrials.gov)
CAR-T细胞疗法最新动态:第四款CAR-T细胞上市,细胞免疫疗法或将进入新纪元
2021年2月5日,美国FDA宣布:第4款CAR-T细胞疗法获批上市。这是Juno Therapeutics公司研发的CAR-T疗法lisocabtagene maraleucel(liso-cel,JCAR017)已被FDA批准用于治疗至少接受过2种其他全身疗法后无应答或者复发的大B细胞淋巴瘤成人(LBCL)患者,商品名为Breyanzi。
表1: 截止2021年2月全球已上市CAR-T细胞疗法

作为FDA批准的第4款CAR-T细胞疗法,此次获批的Breyanzi其适应症也是血液肿瘤,靶点依旧是CD19。作为最常见的恶性淋巴瘤,弥漫性大B细胞淋巴瘤(DLBCL)患者有接近30~40%在一线治疗后无法缓解,或短期缓解后出现复发,因此,对于这无法接受一线治疗并且不适合高剂量化疗(HDC)患者来说,他们仍迫切需要更多的治疗选择。
Breyanzi是一款靶向CD19抗原的自体CAR-T疗法。这款CAR-T细胞免疫疗法的独特之处在于:Breyanzi疗法可调控CAR-T细胞中CD8阳性和CD4阳性细胞的比例,从而可以最大化避免毒副反应发生。
Breyanzi在美国获批主要基于TRANSCEND NHL 001研究结果[1]。该研究共入组了269例R/R LBCL(包括DLBCL)患者,数据显示:在疗效可评估(n=256)患者中,Breyanzi治疗的总缓解率(ORR)为73%,完全缓解率(CR)为53%,且缓解在所有患者亚组中相似。中位随访12个月,中位缓解持续时间(DOR)尚未达到,中位PFS为6.8个月,中位OS为21.1个月。在病情获得完全缓解的患者中,中位PFS和OS尚未达到,在12个月时,有65.1%的患者病情没有进展、有85.5%的患者存活。
安全性方面,在所有患者中,约79%(213/269)的患者发生3级以上不良事件(TEAE),如中性粒细胞减少(60%,161/269)、贫血(38%,101/269)和血小板减少(27%,72/269)。其中,42%(113/269)的患者出现细胞因子释放综合征(CRS),30%(80/269)的患者出现神经系统毒性(NT)事件,但3级以上CRS和NT发生率均较低,且大多数CRS和NT是可逆的。
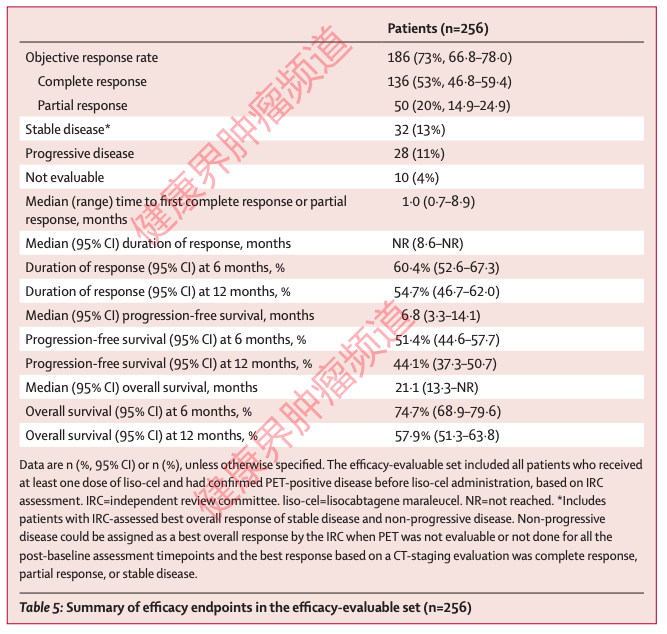
图2: TRANSCEND NHL 001临床试验结果
CAR-T细胞全球研发格局火热,未来趋势难定
我们通常认为,2017年是CAR-T细胞疗法的元年,但在2017年以前,CAR-T细胞从出现到上市已超过二十余年,同时,尽管CAR-T带来了攻克癌症的希望,但是一个不容忽视的问题是,这一疗法在实体瘤治疗上成效不尽人意。因此,许多人并不看好CAR-T细胞疗法的未来发展,认为这是一个“黄昏产业”。然而,伴随着第4代CAR-T细胞的上市,我们不难看出,CAR-T细胞免疫疗法领域仍在蒸蒸日上。
而在中国,CAR-T临床试验数量自2016年起呈现 “井喷式”发展,截止2021年2月25日,在肿瘤治疗领域,中国已开展CAR-T临床试验高达465项,位居全球首位,占比近50%。CAR-T细胞疗法也被认为是国内企业最有希望跟上全球研发步伐的领域之一,虽然至今国内尚未有产品上市,但国内企业的布局依然如火如荼。
CAR-T细胞疗法全球专利格局:中国发展趋势火热,但创新不足
2020年12月,中国学者在Nature Biotechnology期刊上发表了一篇文章,通过专利扫描,从“时间-空间-组织-技术”四个维度综合分析了CAR-T的全球专利布局,首次提供了该领域的专利技术“航拍图”[2]。
该研究首先将专利持有者进行统计,结果显示美国宾夕法尼亚大学、制药公司百时美施贵宝以及瑞士诺华公司位列前三,前二十名专利权人中仅有一家中国公司,排名第18。

图3: CAR专利持有机构
该研究指出,美国的几家大学和制药公司之间形成了强大的合作网络,在CAR-T细胞研发领域位居全球领先位置。同时,中国在CAR-T领域发展并不算早,但速度非常快。不仅凭借巨大的市场规模和潜力,吸引全球申请,在2016年首次超过美国成为全球第一的专利公开国;而且就专利权属国而言,中国也于2017年位居全球第二,虽与美国仍有很大差距,但数量上已远远领先欧洲国家。但中国专利权机构数量多、规模小、缺乏合作和国际布局,导致在全球研发网络中处于边缘位置。

图4: CAR-T细胞疗法全球专利数量分析
该研究还指出,CD19仍是CAR-T细胞最为常见的靶点,其次是BCMA和CD20,间皮素(Mesothelin),而PD-1和HER-2与免疫检查点抑制剂相关的靶点也紧随其后。
同时,我们需要注意的是,在2020年9月,一篇发表在Nature Reviews Drug Discovery杂志上的文章指出,美国大多数细胞免疫疗法是由制药业申请研发,而在中国,大多数细胞疗法的研发申请是由学术机构提出,且主要出于临床前研发阶段,靶点也聚焦于血液系统肿瘤[3]。这也进一步说明了我国在CAR-T细胞研发领域,仍存在创新不足的情况。

图5: CAR-T细胞疗法全球研发管道分析
国产CAR-T细胞疗法蓄势待发,未来可期
其实,在过去的一年中,中国产业界开发的细胞疗法已经超过了学术界开发的细胞疗法数量,同时,中国CAR-T细胞领域的临床前资产在一年中几乎翻了三倍,从69个增加到202个,但是这些资产中有多少会发展到后期阶段尚待观察。
我们更应该看到,CAR-T产品迄今被批准的适应症群体都是末线治疗后难治或复发的病人。从原理上看,CAR-T产品没有理由不能成为二线或一线的标准治疗方案。当然,这需要通过严谨的随机对照临床试验来进行循证及验证,并获得监管部门的审批和许可。一旦CAR-T产品的临床应用可以前移,将有更多的患者能尽早获益。
参考资料:
[1] Abramson J S, Palomba M L, Gordon L I, Lunning M A, Wang M, Arnason J, Mehta A, Purev E, Maloney D G, Andreadis C, et al. Lisocabtagene maraleucel for patients with relapsed or refractory large B-cell lymphomas (TRANSCEND NHL 001): a multicentre seamless design study. Lancet. 2020, 396 (10254): 839-852.
[2] Lyu L, Feng Y, Chen X, and Hu Y. The global chimeric antigen receptor T (CAR-T) cell therapy patent landscape. Nature Biotechnology. 2020, 38 (12): 1387-1394.
[3] Yu J X, Upadhaya S, Tatake R, Barkalow F, and Hubbard-Lucey V M. Cancer cell therapies: the clinical trial landscape. Nat Rev Drug Discov. 2020, 19 (9): 583-584.

不感兴趣
看过了
取消

人点赞

人收藏

打赏
不感兴趣
看过了
取消






您已认证成功,可享专属会员优惠,买1年送3个月!
开通会员,资料、课程、直播、报告等海量内容免费看!

打赏作者
认可我就打赏我~
1元 5元 10元 20元 50元 其它
打赏作者
认可我就打赏我~
扫描二维码
立即打赏给Ta吧!
温馨提示:仅支持微信支付!
已收到您的咨询诉求 我们会尽快联系您
