


人人都能学懂CAR-T(四)|实体瘤的CAR-T细胞治疗
CAR-T治疗实体瘤的机遇与挑战并存,攻克科学难题的同时为实体瘤患者送去福音。期待更好的CAR-T,期待更好的治疗效果!
在上一篇文章中【人人都能学懂CAR-T(三)丨CAR-T细胞疗法治疗血液系统肿瘤的临床应用现状】,我们介绍了CAR -T细胞免疫疗法在血液系统肿瘤领域中显示出令人振奋的临床治疗效果,CAR-T细胞免疫疗法治疗恶性肿瘤进入新纪元。
CAR-T细胞在血液系统肿瘤中取得的疗效,大大激发了研究者对 CAR-T细胞在实体瘤治疗中的兴趣。尤其是针对不同肿瘤抗原为靶点的CAR-T细胞,目前已开展多项基础实验和早期临床试验。本文将主要介绍CAR-T细胞免疫疗法在实体瘤中的应用及其面临的挑战。
在神经母细胞瘤中,以神经节苷脂2(diasialoganglioside 2,GD2)靶向的 CAR-T 细胞治疗取得了显著疗效。结果显示,在19例高危神经母细胞瘤患者中有3例患者完全缓解。早在2011年,Louis等研究者第一次构建了 GD2 靶向的 CAR-T 细胞治疗神经母细胞瘤,该实验也成为了CAR-T 细胞治疗实体瘤中的经典实验[1]。目前靶向GD2的 CAR-T 细胞在实体瘤中的疗效最为显著,最有希望进入Ⅲ期临床试验。
表1:靶向GD-2的CAR-T细胞治疗实体瘤临床试验清单

注:可通过ID在https://clinicaltrials.gov找到试验信息
在肝细胞癌(Hepatocellular carcinoma,HCC)中,CAR-T细胞免疫疗法也取得一定治疗效果。研究者设计了靶向磷脂酰肌醇蛋白聚糖 3(glypican-3,GPC3)的第三代CAR-T细胞,通过体内外实验对CAR-T细胞在肝细胞癌中的作用进行探究。CAR-T细胞可在体外有效杀死GPC3阳性的HCC细胞,在体内,CAR-T细胞可以清除高表达GPC3的HCC异种移植物,有效抑制低表达GPC3的HCC异种移植物的生长,并且显著延长荷瘤小鼠的存活率[2]。2018 年该研究团队在ASCO 大会上发表了Ⅰ期临床试验的初步结果,13例HCC患者接受靶向GPC3的CAR-T细胞治疗,所有试验患者均显示出对CAR-T细胞治疗的耐受。
表2:靶向GPC3的CAR-T细胞治疗肝细胞癌临床试验清单

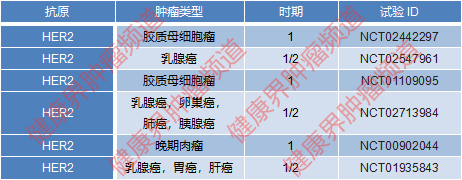
人表皮生长因子受体(human epidermal growth factor receptor-2,HER2)在胃癌、胰腺癌等多种肿瘤组织中过表达,其异常激活与肿瘤的不良预后密切相关,是近年来广泛研究的靶点之一。根据HER2在实体瘤中的作用,研究者们设计了靶向HET2的CAR-T细胞。前期研究者们通过大量的试验验证了此种CAR-T细胞对HER2阳性细胞的有效性[3]。在HER2阳性晚期胆道癌和胰腺癌的I期临床试验中,共有11例晚期不可切除,复发或转移患者接受靶向HER2的CAR-T细胞免疫治疗,大都取得一定的治疗效果[4]。
表3:靶向HER2的CAR-T细胞治疗实体瘤的临床试验清单
间皮素(mesothelin,MSLN)是一种锚连在膜表面的糖蛋白,在多种肿瘤中高表达,与肿瘤增殖、侵袭和不良预后有密切联系。与HER2一样,MSLN也是免疫治疗的热门研究靶点。在一项靶向MSLN的CAR-T细胞I期临床试验中,6例胰腺癌患者均表现出不同的抗肿瘤的能力[5]。
表4:靶向MSLN的CAR-T细胞治疗实体瘤临床试验清单

尽管CAR-T细胞在治疗实体瘤中取得了初步的疗效,但其治疗效果与血液瘤相比还存在着差距。由于实体瘤的许多特殊性质,CAR-T细胞治疗具有严重的不良反应风险,已导致死亡和许多临床试验的中断,因此CAR-T细胞在实体瘤治疗中面临着更多的挑战。
CAR-T 细胞在体内的运输
实体瘤可通过干扰T细胞运输来进行免疫逃逸。由于趋化因子-趋化因子受体错配,黏附分子下调和肿瘤新脉管系统异常等原因,导致CAR-T 细胞难以精确归巢。研究表明,改善T细胞向肿瘤部位的运输
实体瘤浸润
当CAR-T细胞成功运输到肿瘤部位后,还需要渗透到肿瘤细胞区域发挥作用。与血液瘤所处的均质环境相比较,实体瘤外部有癌症相关的成纤维细胞产生的致密的细胞外基质组成的物理屏障,能够捕获并阻止CAR-T细胞穿透肿瘤,阻碍CAR-T细胞的浸润,减弱其杀伤活性。
肿瘤微环境(TME)的免疫抑制作用
TME的免疫抑制作用很大程度地限制了CAR-T 细胞在实体瘤中的临床应用。TME是一种癌细胞重新设计以促进其生长的微环境[7]。TME具有低氧、低营养、低 pH、高渗透的特点,不利于CAR-T 细胞的存活。此外,TME中还包含多种免疫抑制细胞(肿瘤相关的巨噬细胞、调节性T 细胞等)和免疫检查点(程序性细胞死亡受体1、细胞毒性 T 淋巴细胞相关蛋白 4),通过多种途径抑制CAR-T 细胞发挥杀伤活性。改善TME引起的免疫抑制作用将极大提高CAR-T细胞在实体瘤中的临床治疗效果。
肿瘤抗原的短缺
实体瘤中CAR-T细胞治疗面临的重要挑战之一是无法获得实体瘤特异性抗原。肿瘤抗原主要分为两类:一类是肿瘤特异性抗原(TSA),在肿瘤细胞上特异性表达。第二类是肿瘤相关抗原(TAA),TAA在正常组织细胞上也有微弱表达。本文中提到的GD2,HER2,GPC3等都是代表性TAA。因此,CAR-T 细胞在清除肿瘤细胞的同时,也有可能错误地攻击正常组织细胞,即脱靶效应,使得CAR-T细胞疗法不能得到预期的治疗效果。TSA的短缺严重限制了CAR-T治疗实体瘤的效果,找到合适的治疗靶点是实体瘤CAR-T治疗亟待解决的重要问题,也更具挑战性[7]。
表5:各种癌症类型中CAR-T细胞功能的限制因素

注:EGFR, epidermal growth factor receptor,表皮生长因子受体;MUC1, mucin 1 cell surface-associated,黏蛋白1;CEA, carcinoembryonic antigen,癌胚抗原;EpCAM, epithelial cell adhesion molecule, 上皮细胞粘附分子;PSCA, prostate stem cell antigen, 前列腺干细胞抗原。
实体瘤CAR-T治疗道阻且长。这些困难对研究者是挑战的同时也是机遇,如图1所示。针对不同的挑战进行进一步的研究,以克服当前研究策略的局限性,为CAR-T治疗实体瘤提供新的思路。

图1:CAR-T细胞治疗实体瘤新策略
参考资料:
1. Louis, C.U., et al., Antitumor activity and long-term fate of chimeric antigen receptor-positive T cells in patients with neuroblastoma. Blood, 2011. 118(23): p. 6050-6.
2. Gao, H., et al., Development of T cells redirected to glypican-3 for the treatment of hepatocellular carcinoma. Clin Cancer Res, 2014. 20(24): p. 6418-28.
3. Song, Y., et al., Effective and persistent antitumor activity of HER2-directed CAR-T cells against gastric cancer cells in vitro and xenotransplanted tumors in vivo. Protein Cell, 2018. 9(10): p. 867-878.
4. Feng, K., et al., Phase I study of chimeric antigen receptor modified T cells in treating HER2-positive advanced biliary tract cancers and pancreatic cancers. Protein Cell, 2018. 9(10): p. 838-847.
5. Beatty, G.L., et al., Activity of Mesothelin-Specific Chimeric Antigen Receptor T Cells Against Pancreatic Carcinoma Metastases in a Phase 1 Trial. Gastroenterology, 2018. 155(1): p. 29-32.
6. Idorn, M. and P. Thor Straten, Chemokine Receptors and Exercise to Tackle the Inadequacy of T Cell Homing to the Tumor Site. Cells, 2018. 7(8).
7. Jo, Y., et al., Innovative CAR-T Cell Therapy for Solid Tumor; Current Duel between CAR-T Spear and Tumor Shield. Cancers (Basel), 2020. 12(8).

不感兴趣
看过了
取消

人点赞

人收藏

打赏
不感兴趣
看过了
取消






您已认证成功,可享专属会员优惠,买1年送3个月!
开通会员,资料、课程、直播、报告等海量内容免费看!

打赏作者
认可我就打赏我~
1元 5元 10元 20元 50元 其它
打赏作者
认可我就打赏我~
扫描二维码
立即打赏给Ta吧!
温馨提示:仅支持微信支付!
已收到您的咨询诉求 我们会尽快联系您
