
由于HER2突变和HER2融合在乳腺癌中的发生频率较低,因此靶向HER2疗法在这类人群中的临床特征和疗效尚不清楚。
由于HER2突变和HER2融合在乳腺癌中的发生频率较低,因此靶向HER2疗法在这类人群中的临床特征和疗效尚不清楚。研究者回顾性分析了2017年1月1日至2021年1月1日就诊于北京大学人民医院的HER2突变和/或HER2融合的晚期乳腺癌患者。
22例患者中共检测到17种HER2突变,分别为L755S、S310F、R100=、V777L、R897W、T862A、440-17C>G、H878Y、V842I、73+9G>C、T278fs、E1069K、L755P、226-11C>T、574+12C>T、L114V 和 P128L。患者多为导管癌,多合并HER2扩增/过表达。在一线治疗中,22例患者的中位无进展生存期(PFS)为6.9个月(95%CI:4.7,9.1)。一线治疗接受基于曲妥珠单抗治疗方案的患者中位PFS显著长于接受酪氨酸激酶抑制剂(TKI)的患者[10.8个月(95%CI:2.9,18.7)vs. 1.9个月(95%CI:0.8,3.0),p<0.005]。共14例患者接受了抗HER2抗体-药物偶联物(ADC)治疗,首次给予抗HER2 ADC治疗的中位治疗线为4.5(范围:1-10)。从首次给药开始,抗HER2 ADC的客观缓解率(ORR)为42.9%,疾病控制率(DCR)为85.7%,中位PFS为7.3个月(95%CI:4.4-10.1)。
本研究数据表明抗HER2治疗在HER2突变和/或融合的中国乳腺癌患者中具有良好的临床获益。个体HER2变异的免疫治疗和治疗选择的价值有待进一步研究。
研究背景
HER2阳性乳腺癌约占所有乳腺肿瘤病例的10%-20%。基于几项大规模前瞻性临床试验,靶向这种HER2扩增/过表达的多种治疗策略已被推荐,包括单克隆抗体、激酶抑制剂和抗体-药物偶联物(ADC)。多年来,抗HER2药物的应用显著改善了HER2阳性乳腺癌人群的总生存期(OS)。除HER2扩增外,HER2基因突变也见于约4%的多种类型乳腺癌中,具有致癌作用,表明另外一个患者群体可能是靶向HER2治疗的潜在目标人群。几项研究发现,有HER2基因突变的患者预后劣于无突变的患者。HER2基因融合更为罕见,几乎没有相关数据报道。由于HER2突变和HER2融合的发生率较低,目前缺乏各种HER2突变/融合的临床数据,不同治疗策略的临床获益尚不明确。对于HER2突变/融合的乳腺癌患者,目前尚无统一的标准治疗方案,探索最佳治疗策略是亟待解决的医疗需求。研究者进行了这项回顾性研究,以评估在该癌症中心,各种治疗方案对晚期HER2突变/HER2融合乳腺癌患者的真实世界临床影响。
研究结果
患者特征:
2017年1月1日至2021年1月1日,22例符合纳入标准的HER2变异(突变和融合)晚期乳腺癌女性患者纳入本研究。患者的中位年龄为47.7(范围:28-70)岁,21例(95.5%)为乳腺导管癌,1例(4.5%)为乳腺小叶癌。22例患者中,确诊时为I期5例,II期4例,III期10例,IV期3例。18例患者均为早期发病,均行根治性手术。早期癌症患者术后中位DFS为17.2个月(95%CI:11.0-23.5)。22例患者的临床特征见表1。22例患者中,激素受体(HR)阳性/HER2阴性5例,HR阳性/HER2阳性5例,HR阴性/HER2阳性12例,无一例HR阴性/HER2阴性。
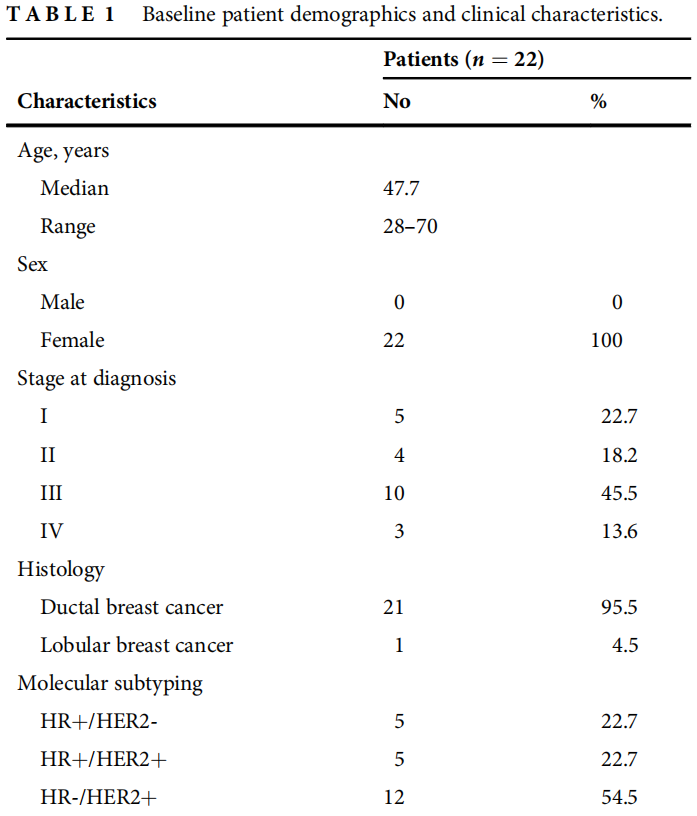
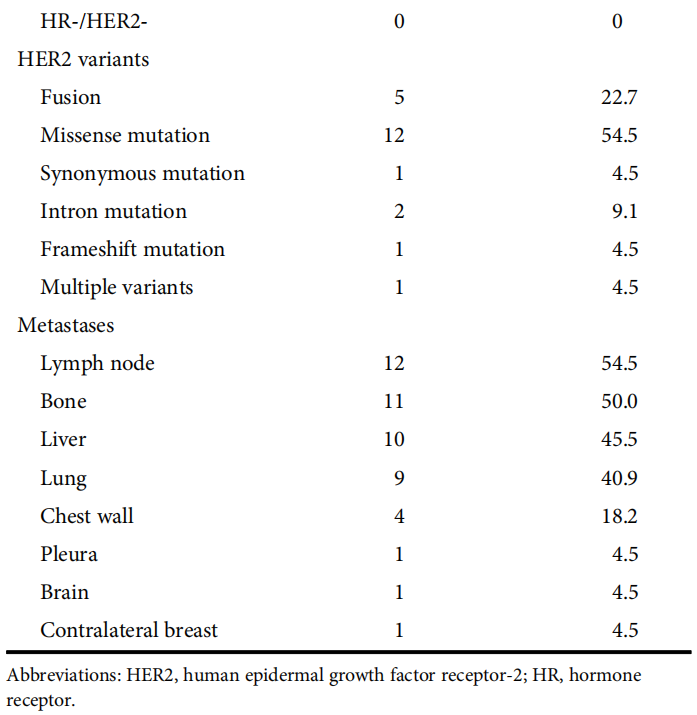
表1
突变发生率:
共检测出26种HER2变异(图1),5例患者有HER2融合,包括TAF2-ERBB2(n=1)、GRB7-ERBB2(n=1)、PTK2-ERBB2(n=1)、GALNTL6-ERBB2(n=1)和ACACA-ERBB2(n=1)。共有16例患者发生HER2 突变,包括L755S(n=3)、S310F(n=2)、R100=(n=1)、V777L(n=1)、R897W(n=1)、T862A(n=1)、440-17C>G(n=1)、H878Y(n=1)、V842I(n=1)、73+9 G>C(n=1)、T278fs(n=1)、E1069K(n=1)和L755P(n=1)。1例患者同时存在HER2突变和HER2融合(226-11C>T、574+12C>T、L114V、P128L和IFT122-ERBB2融合)。最常见的突变类型为错义突变(14/26,53.8%),其次为HER2融合(6/26,23.1%)、内含子突变(6/26,23.1%)、同义突变(1/26,3.8%)和移码突变(1/26,3.8%)。22例患者中,17例同时存在HER2扩增/过表达,5例为HER2阴性。9例HER2突变患者和1例HER2融合患者雌激素受体(ER)和(或)孕激素受体(PR)阳性。
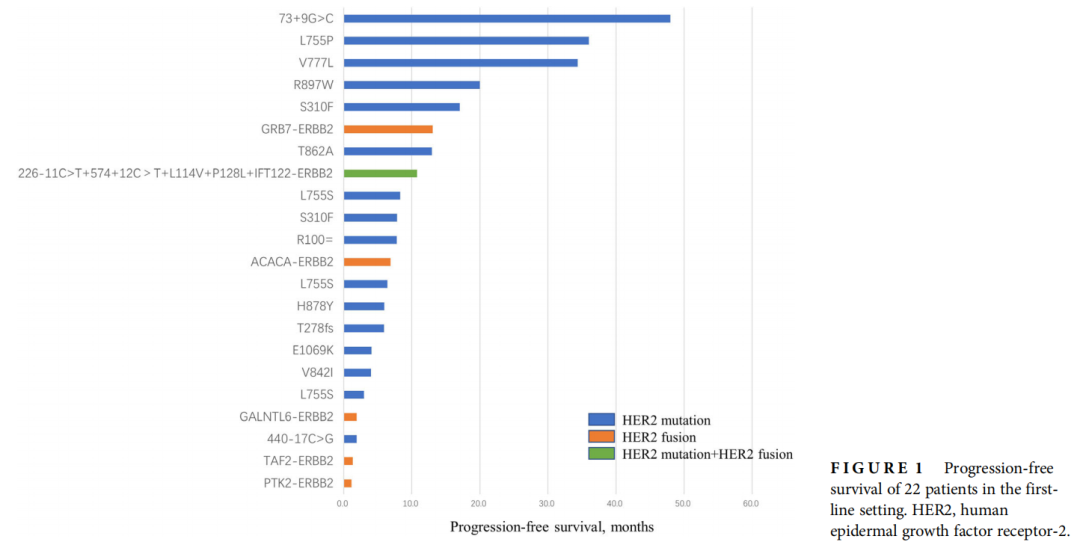
图1
一线治疗的临床结果:
共有16例HER2阳性患者接受了一线抗HER2治疗,其中10例接受了基于靶向HER2抗体的治疗方案(曲妥珠单抗±帕妥珠单抗联合化疗)。5例HER2阳性患者接受了抗HER2酪氨酸激酶抑制剂(TKI)联合化疗,1例患者接受了靶向HER2 ADC的一线治疗,因为他们之前接受过1年的曲妥珠单抗辅助治疗,DFS均未达到2年。另1例HER2阳性患者根据患者意愿和可及性单独接受化疗。5例HR阳性/ HER2阴性患者接受内分泌治疗作为一线治疗。
总体上,CR 1例,PR 11例,SD 5例,PD 5例,客观缓解率(ORR)为54.5%,疾病控制率(DCR)为77.3%。在一线治疗中,22例患者的中位PFS为6.9个月(95%CI:4.7,9.1)。在接受基于曲妥珠单抗治疗的10例患者中,共有16种靶向HER2治疗达到了100%的DCR,而在接受TKI治疗的5例患者中,DCR为40%(p=0.022)。以曲妥珠单抗为基础的一线治疗和以TKI为基础的一线治疗的ORR分别为90.0%和20.0%(p=0.017)。接受一线靶向HER2抗体方案的患者中位PFS显著长于接受一线TKI的患者(10.8个月[95%CI:2.9,18.7] vs. 1.9个月[95%CI:0.8,3.0],p<0.005)。在一线治疗中,接受靶向HER2 ADC治疗的患者达到了PR,PFS为8.3个月。
靶向HER2治疗方案的疗效:
在本研究中,15例患者接受了基于靶向HER2抗体曲妥珠单抗(联合化疗)的治疗,首次应用曲妥珠单抗为基础的治疗方案的中位治疗线为1(范围:1-7)。15例患者的ORR为66.7%,DCR为93.3%,中位PFS为6.9个月(95%CI:5.2,8.5)。共15例患者接受了抗HER2 TKI(联合化疗)治疗,首次接受TKI治疗的中位治疗线为3(范围:1-9)。首次应用抗HER2 TKI的ORR和DCR分别为26.7%和66.7%,中位PFS为4.1个月(95%CI:3.5,4.7)。14例患者接受过抗HER2 ADC治疗,首次应用抗HER2 ADC的中位治疗线为4.5(范围:1-10)。首次给药时,抗HER2 ADC的ORR为42.9%,DCR为85.7%,中位PFS为7.3个月(95%CI:4.4,10.1)。9例患者接受了抗HER2 TKI联合曲妥珠单抗方案治疗,首次接受联合治疗的中位治疗线数为3(范围:2-8)。在首次给药的情况下,联合治疗的ORR为44.4%,DCR为55.6%,中位PFS为4.7个月(95%CI:0.0,11.4)。表2列出了抗HER2治疗的临床结局。
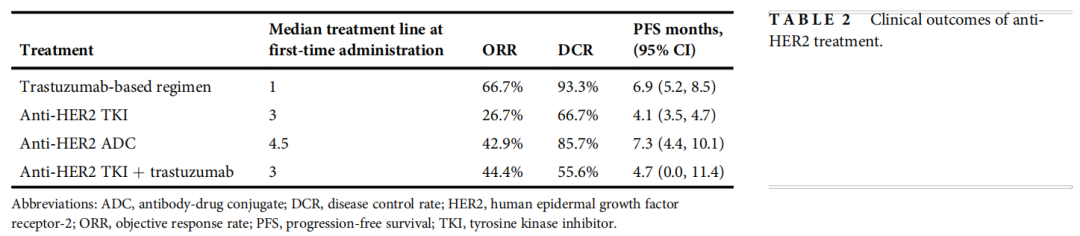
表2
HER2突变和HER2融合的临床结局:
5例HER2融合患者中,一线治疗后2例PR,3例PD,中位PFS为1.9个月(95%CI:0.8-3.0)。表3列出了多种HER2融合的临床结局。共有16例患者携带HER2突变,一线治疗后9例PR,5例SD,2例PD,在多种HER2突变类型中观察到应答者,包括L755S、R100=、V777L、R897W、T862A、73+9G>C、T278fs和L755P。ORR和DCR分别为56.3%和87.5%。一线治疗中HER2突变患者的中位PFS长于HER2融合患者,但差异无统计学意义(7.8个月[95%CI:4.9,10.7] vs. 1.9个月[95%CI:0.8,3.0],p=0.07)。1例合并HER2突变和HER2融合的患者在含曲妥珠单抗的一线治疗方案中获得CR,在含拉帕替尼的二线治疗方案中获得PR,在抗HER2 ADC治疗中获得PR。在本研究数据集中HER2扩增阳性/突变阳性(HER2+/mut)患者共12例,均接受以曲妥珠单抗为基础的治疗。HER2+/mut人群首次使用含曲妥珠单抗方案的中位治疗线为1(范围:1-7),ORR为58.3%,DCR为91.7%,中位PFS为5.9个月(95%CI:4.1-7.8)。12例HER2+/mut患者中共有11例接受了抗HER2 TKI治疗,首次使用TKI的中位治疗线为4(范围:1-7)。ORR和DCR分别为27.3%和72.7%,中位PFS为4.1个月(95%CI:3.2-5.0)。
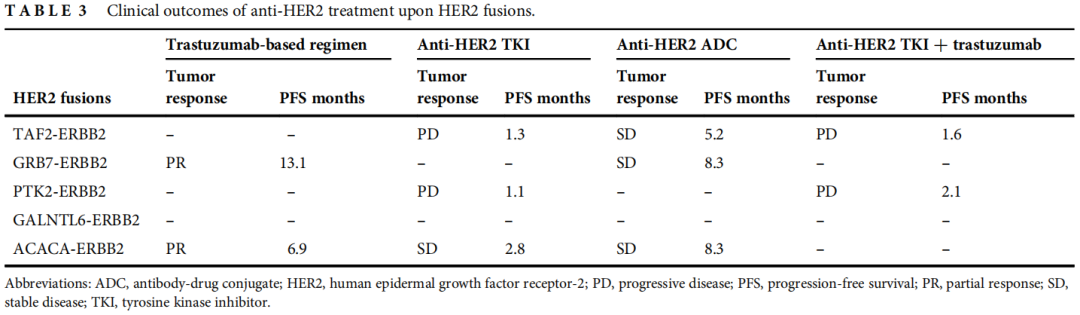
表3
讨 论
HER2是乳腺癌中研究最充分的基因之一。HER2扩增/过表达(HER2阳性)与乳腺肿瘤的发生、发展有关,是一种预后指标。靶向HER2疗法(包括靶向HER2抗体、TKI和ADC)的引入显著改善了HER2阳性肿瘤患者的肿瘤学结局。相比之下,HER2突变见于约2%-4%的乳腺癌,由于其发生率较低,尚未得到充分报道。已有研究报道了携带HER2突变和/或HER2融合的乳腺癌患者的临床病理特征,本研究主要探讨这些患者中不同HER2基因组亚型的治疗模式和临床结局。
据报道,HER2突变与乳腺癌的既往治疗无关,在浸润性小叶乳腺癌中发生率相对较高(约10%-15%)。据报道,约70%的HER2突变发生在氨基酸755和781(外显子19和20)之间的激酶结构域,约20%的突变发生在氨基酸309或310(外显子8)之间的胞外结构域(ECD)。在临床前研究中,Bose等人发现HER2 R678Q、I767M和Y835F突变不产生功能影响,而HER2 G309A、L755S、D769H/Y、V777L、P780_781insGSP、V842I和R896Q突变导致HER2信号传导增加和肿瘤生长增加。获得性HER2突变诱导的耐药在HER2阳性肿瘤中也很常见。据报道,在拉帕替尼和/或曲妥珠单抗治疗期间,T798M突变和L755S突变可诱导HER2再激活。之前的一项研究报道,HER2扩增肿瘤的HER2突变频率高于HER2阴性肿瘤(19.5% vs. 4.8%;p<0.001),其中最常见的V777L、L755S和D769Y突变均被预测为驱动基因突变。本研究结果显示,HER2突变同样大多与HER2扩增/过表达同时存在,22例患者中有21例(95.5%)为导管癌,L755S、S310F 突变是最常见的。
此外,Croessmann等人报道,70%的HER2突变是在转移性ER+肿瘤中发现的,这提示HER2突变的出现可能导致内分泌治疗耐药。数项临床前研究表明,在HER2 L755S和V777L突变型乳腺癌患者中,加用来那替尼可恢复对氟维司群的敏感性。SUMMIT试验随后探讨了来那替尼和氟维司群联合治疗HER2突变、ER+转移性乳腺癌患者。联合治疗患者的初步结果显示ORR为29.8%,中位PFS为5.4个月(95%CI:3.7,9.2)。在本研究中,10例患者为ER+,大多接受内分泌治疗。仅1例HER2 V777L突变患者在8线接受拉帕替尼联合氟维司群治疗,获得SD。由于内分泌治疗在ER+乳腺癌中的突出临床表现,抗HER2治疗可能主要在更后面的治疗线中发挥作用。在既往接受过较少治疗的HER2突变、ER+乳腺癌患者中,多种抗HER2疗法联合内分泌治疗的临床获益需要进一步研究。
HER2突变已被证明通过持续激活HER2酪氨酸激酶活性或通过增加HER2与EGFR家族其他成员的二聚化发挥致癌作用。为了确定HER2突变在HER2+乳腺癌患者中是否具有预测价值,研究者分析了基于曲妥珠单抗的治疗在HER2+/mut人群中的临床结果。然而,在本研究中,以曲妥珠单抗为基础的治疗的缓解率和PFS较低。在之前的一项研究中,也发现HER2突变病例对曲妥珠单抗耐药。在MYPATHWAY试验中,最初36例接受曲妥珠单抗联合帕妥珠单抗治疗的HER2突变且无扩增/过表达的肿瘤患者中,未发现乳腺癌患者有应答。
多项研究报道了抗癌治疗与免疫系统之间的相互作用,并且HER2阳性乳腺癌通常含有大量T细胞浸润。I/II试验PANACEA表明,在一组接受过曲妥珠单抗治疗的转移性HER2阳性患者中,15%的PD-L1阳性患者对曲妥珠单抗联合帕博利珠单抗治疗有应答。在随机II期KATE-2研究中,与T-DM1单药治疗相比,T-DM1联合阿替利珠单抗在曲妥珠单抗经治的HER2阳性、PD-L1阳性人群中显示出OS获益的趋势。由于免疫治疗在PD-L1阳性、曲妥珠单抗耐药的HER2阳性乳腺癌患者中显示出活性和持久的临床获益,因此需要对HER2突变人群的TILs水平、PD-L1状态和免疫治疗的临床获益进行进一步研究。
考虑到已发现HER2突变聚集在HER2蛋白的酪氨酸激酶和细胞外结构域,并且可能被不可逆的TKI抑制剂(如来那替尼)抵消,研究者随后在HER2+/mut人群中分析了HER2突变对抗HER2 TKI疗效的影响。Cocco等人证明,HER2突变的存在可限制HER2扩增乳腺癌患者对曲妥珠单抗和拉帕替尼的敏感性,而对来那替尼单药治疗仍敏感。SUMMIT试验探讨了来那替尼对HER2突变肿瘤的疗效,结果显示乳腺癌患者的ORR为32%。在ER+和ER-、HER2非扩增的肿瘤中均观察到缓解。在本研究中,可逆性TKI(包括吡咯替尼和拉帕替尼)主要用于曲妥珠单抗经治的患者,研究者发现与既往研究中HER2阳性患者相比,TKI在HER2+/mut人群中的获益幅度并不令人满意。在吡罗替尼的I期和II期临床试验中,46例患者中有8例有HER2突变。HER2突变型患者的中位PFS短于HER2野生型患者。综上所述,这些数据提示,无论HER2基因拷贝数状态如何,以不可逆TKI来那替尼为基础的治疗可能是HER2突变型乳腺癌的一个可选治疗选择。需要大规模随机研究来验证这些初步发现。
曲妥珠单抗联合拉帕替尼之前已在1例既往接受过大量治疗的含有HER2 V777L和S310F突变的炎性乳腺癌患者中显示出临床疗效。本研究同样证明了曲妥珠单抗和TKI联合治疗的临床获益。考虑到联合治疗能够通过更完全地抑制HER2信号通路来克服代偿反馈机制,因此还应该进一步研究多种HER2靶向治疗的潜在益处。
之前的一项研究表明,无论细胞膜上的受体水平如何,HER2突变都可能促进TDM-1的内化。基于这一现象,无论HER2扩增/表达状态如何,抗HER2 ADC在HER2突变的肿瘤中可能更具有活性。总体而言,本研究中接受抗HER2 ADC治疗的患者既往接受过大量治疗,其中大多数患者在接受曲妥珠单抗和TKI为基础的治疗方案后发生疾病进展。本研究中抗HER2 ADC的临床疗效较好,ORR为42.9%,中位PFS为7.3个月(95%CI:4.4-10.1)。由于新型抗HER2 ADC DS-8201a在HER2阳性和HER2低表达的乳腺癌中显示出显著的活性,因此有必要在HER2突变人群中对新一代抗HER2 ADC进行进一步研究。
多种靶向HER2治疗对HER2突变人群的临床益处不大,这凸显出我们对个体患者HER2突变的生物学和靶向性的理解尚不完全。HER3突变、PI3K/mTOR/AKT通路等下游或平行致癌通路的激活可能是导致这一现象的原因,联合下游或平行通路抑制剂治疗可能会获得更好的疗效。
在本研究中也检测到一些HER2基因融合。TCGA癌症图谱研究报告,HER2融合在乳腺癌、食管癌和宫颈癌中的检出率分别为1.4%、1.7%和1.4%。鉴于患病率较低,其特征及最佳治疗方案有待进一步研究。
本研究为单中心、回顾性研究,具有局限性。HER2突变/融合病例数量少,限制了研究者对治疗选择和结局的解读能力。此外,本研究缺乏独立的影响学审查委员会来重新评估治疗结局,因此研究者将DCR和PFS作为主要终点。需要在更大样本量的中国HER2突变/融合患者中开展多中心、前瞻性研究。
总之,本研究描述了HER2突变和/或HER2融合乳腺癌患者的临床病理特征和靶向HER2治疗的临床结局。以曲妥珠单抗为基础的治疗方案和抗HER2 TKI的临床获益一般,而抗HER2 ADC显示出有前景的疗效。在个体患者中HER2突变/融合的生物学特性和可靶向性,以及预测治疗反应的因素需要进一步研究。
参考文献:
Mu, Yuxin et al. “Clinical characteristics and treatment outcomes of HER2 mutation and HER2 fusion in 22 patients with advanced breast cancer.” Thoracic cancer vol. 14,34 (2023): 3381-3388. doi:10.1111/1759-7714.15130
不感兴趣
看过了
取消

人点赞

人收藏

打赏
不感兴趣
看过了
取消






您已认证成功,可享专属会员优惠,买1年送3个月!
开通会员,资料、课程、直播、报告等海量内容免费看!

打赏金额
认可我就打赏我~
1元 5元 10元 20元 50元 其它
打赏作者
认可我就打赏我~
扫描二维码
立即打赏给Ta吧!
温馨提示:仅支持微信支付!
已收到您的咨询诉求 我们会尽快联系您
