
尽管用于免疫肿瘤学研究的人源化小鼠的发展取得了实质性进展,但这些模型仍然存在局限性。
免疫疗法已经成为许多恶性肿瘤的一种有前途的治疗范例,并正在改变药物开发的格局。虽然免疫治疗药物已显示出临床疗效,但它们与不同的临床反应有关,人们对其作用机制和特异性生物反应标志物的了解仍存在很大差距。目前,能够忠实地概括人类免疫系统和肿瘤之间的相互作用并能够在体内评估人类特异性免疫疗法的临床前模型的数量有限。人源化小鼠是指与人类肿瘤和免疫成分共同移植的免疫缺陷小鼠,为免疫肿瘤学研究提供了几个优势。在这里,讨论目前可用的人源化小鼠的益处和挑战,包括移植的人肿瘤和免疫成分之间的特异性相互作用,这些小鼠中人类天然免疫群体的发育和存活,以及研究植入匹配的患者肿瘤和免疫细胞的小鼠的方法。这里重点介绍人源化小鼠模型的最新进展,旨在为其在免疫肿瘤学研究中的应用提供指导,具有临床转化的潜力。
人源化小鼠模型的实用性
人源化小鼠模型正被用于测试和验证广泛的免疫治疗方法,包括单特异性、双特异性和三特异性抗体的治疗、过继细胞疗法(例如表达CARs或TCRs的细胞)、小分子抑制剂或激动剂以及溶瘤病毒。针对PD-1-PD-L1、CTLA4或LAG3的第一代免疫检查点抑制剂(ICIs)已经在几个人源化小鼠模型中证明了有效性。这些平台还被用于筛选其他新型治疗剂,以了解它们在活体中控制肿瘤生长的能力。FDA已经表示,有兴趣使用人源化的小鼠平台来测试新型治疗剂的有效性和安全性。事实上,目前FDA批准的CAR-T细胞产品最初是在人源化小鼠模型中进行研究的。除了CAR-T细胞产品外,在人源化小鼠身上测试的其他细胞靶向方法包括双特异性T细胞结合蛋白和双亲和重定向分子。最后,人源化的小鼠模型也可能是研究联合免疫疗法的有效工具。
恶性造血疾病的研究导致白血病干细胞和白血病起始细胞的鉴定,这是人源化小鼠模型的另一个重要应用。这一领域的初步研究有助于增进对人类白血病发病机制的理解,并探索治疗策略。
人体免疫系统植入
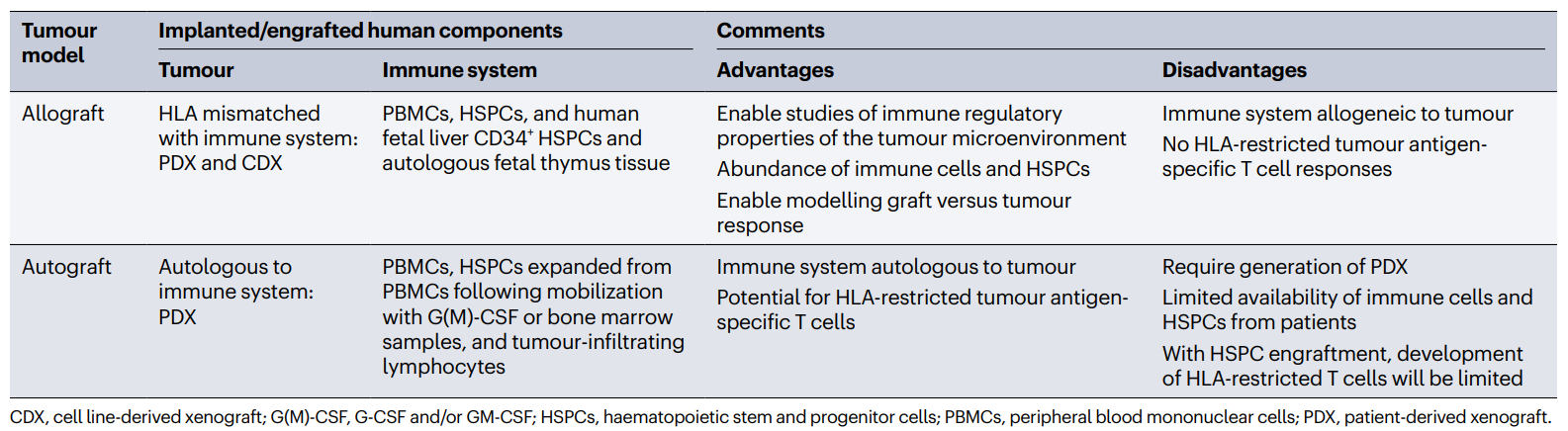
已经开发了几种策略来将人类免疫系统组件植入免疫缺陷小鼠。人源化小鼠实验策略的优化设计需要全面了解植入方案,更重要的是,需要了解它们的整体优势和局限性。事实上,用于植入的特定细胞群影响小鼠体内不同人类免疫细胞类型的相对丰度(通常通过CD45染色来评估,CD45是造血细胞及其前体的表面标记;图1)。鉴于植入方案的复杂性和耗时性,明确定义实验问题以及仔细选择最佳植入策略和免疫缺陷小鼠模型是至关重要的。在这里,提供了用于生成免疫肿瘤学研究中使用的几种人源化模型的植入协议的一般概述,并强调了每种方法的具体创新,特别是与不同免疫细胞类型的发展相关的创新(表1)。为简洁起见,倾向于仅通过名称来引用每种鼠标型号(详细信息见表2)。
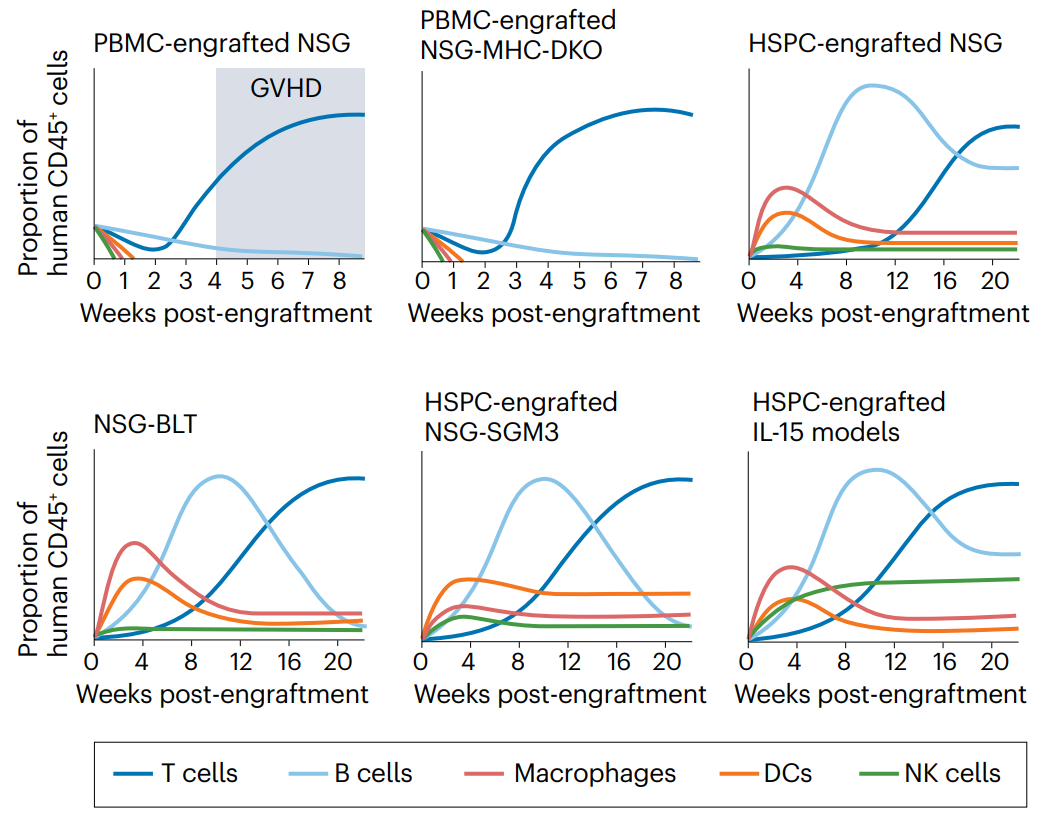
图1 人源化小鼠模型中人类免疫系统发育动力学。
表1 人源化小鼠模型及其在人体免疫细胞功能研究中的适用性
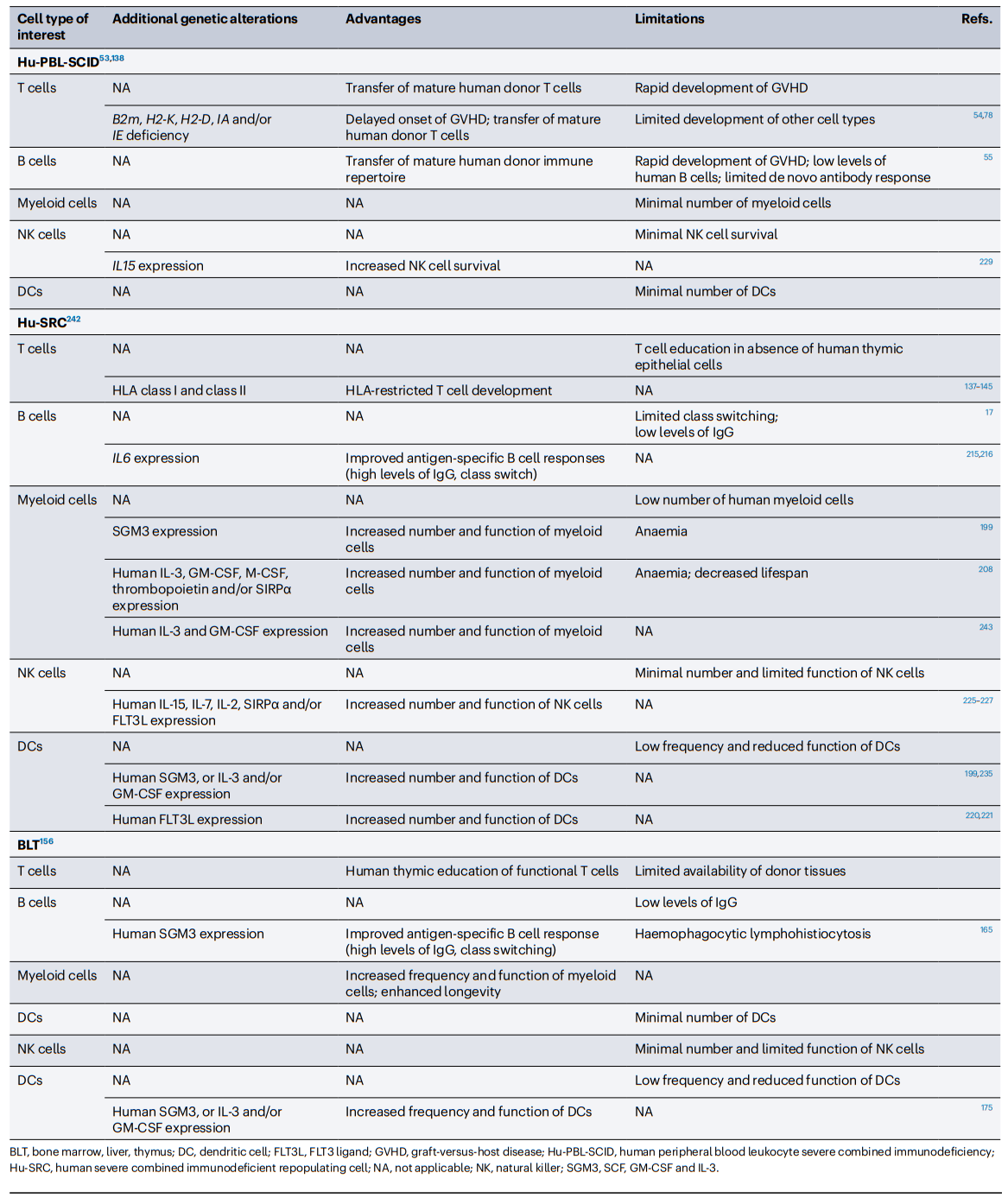
表2 免疫肿瘤学的人源化免疫缺陷小鼠模型的选择
Hu-PBL-SCID小鼠
将人类免疫系统成分植入SCID小鼠的直接方法是直接输注成熟的人类免疫细胞,产生人外周血白细胞(Hu-PBL)SCID小鼠。虽然成熟的人体免疫细胞可以从几个组织(包括脾)获得,但外周血单个核细胞(PBMCs)是最常用的来源。PBMC很容易获得,易于使用,并且可以大量获得。人类CD3+T细胞,包括CD4+和CD8+亚群,是在植入过程中存活下来的最丰富的细胞群,而FOXP3+CD25+CD127低调节T细胞(Treg)在注射后2-4周内可被检测到,但随后在循环中变得不可检测。人先天细胞群体,包括髓系细胞和NK细胞,在小鼠体内最初几天存活,但很快就在血液和组织中检测不到(图1)。人CD19+B细胞在特定部位保持低水平,包括脾和骨髓,持续数周。此外,人IgGs在Hu-PBL-SCID小鼠的整个生命周期内都能在其外周血中检测到。
Hu-PBL-SCID小鼠的免疫肿瘤学研究
Hu-PBL-SCID小鼠已被广泛用于研究人类免疫细胞和人类肿瘤之间的相互作用。一个例子包括关于人T细胞在NOG小鼠生长的胶质母细胞瘤CDX(Prkdc和IL2rg基因被敲除)中的肿瘤渗透的报道,其直接使用PET进行可视化。该模型可以潜在地监测暴露于治疗剂期间的TME。
移植到Hu-PBL-SCID小鼠体内的PBMC可以是自体的也可以是同种异体的,植入的是PDXs和注射的CDXs(表3)。在表达SCF、GM-CSF(也称为CSF2)和IL-3(NSG-SGM3)的NSG(Prkdc和IL2rg基因敲除)小鼠中,移植了卵巢癌PDX和自体PBMC的肿瘤生长受到抑制,这些小鼠暴露于抗PD-1和抗CTLA4抗体,但不单独暴露抗PD-1抗体,与未暴露、未植入NSG-SG3M PDX MICE相比。与未暴露的小鼠相比,移植了胃癌PDX和自体PBMC的BRG小鼠(Rag2和IL2rg基因敲除)与暴露于抗PD-1抗体和/或抗TNFRSF9抗体(也称为CD137)的BRG小鼠相比,肿瘤生长也受到损害。虽然这种“自体移植”的Hu-PBL-SCID模型具有支持HLA限制的肿瘤抗原特异性T细胞研究的优势,但这种方法在逻辑上是复杂的,并且依赖于癌症患者的可用性,这些患者可以捐献血液和肿瘤样本进行临床前研究。
表3 研究人类免疫成分与人类肿瘤相互作用的方法
另一种自体方法包括使用来自与PDX相同的肿瘤组织的体外扩增的肿瘤浸润性淋巴细胞(TIL),而不是PMBC。从黑色素瘤患者的样本中分离出的TIL被体外扩增并注射到表达IL2(hIL2-NOG)的NOG小鼠中,该小鼠已经植入了自体黑色素瘤PDX,导致了肿瘤的根除。在另一项研究中,将暴露于人IL-2的体外扩展TIL注射到携带自体卵巢癌PDX的NSG-SGM3小鼠体内,与未注射的NSG-SGM3 PDX小鼠相比,导致肿瘤生长受损,并增强了抗PD-1和抗CTLA4抗体的组合的效果。
同种异体移植Hu-PBL-SCID模型(表3)也被证明在体内测试一些抗肿瘤药物是有用的。将移植有肾细胞癌CDX的NSG小鼠和移植了同种异体人PBMC的NSG小鼠,用来检测针对由肾癌表达的原型性肿瘤特异性抗原carbonic anhydrase 9的抗体。这种抗体抑制肿瘤的生长,这与肿瘤对人T细胞的渗透和对人NK细胞的更有限的渗透有关。暴露于抗PD-1抗体可降低植入肺癌CDX或PDXs的NSG、NOG和NSI(Prkdc和IL2rg基因敲除)小鼠以及植入骨肉瘤CDXs的NPG小鼠(Prkdc和IL2rg基因敲除)的肿瘤负担,所有这些小鼠都移植了同种异体人PBMC。暴露于一种新的针对人PD-1和PD-L1的双特异性抗体也降低了NSG小鼠的肿瘤负担,这些小鼠植入了肺癌CDX和同种异体PBMCs。在这一模式中,组合方法也得到了成功的测试。
缺乏GVHD的Hu-PBL-SCID模型
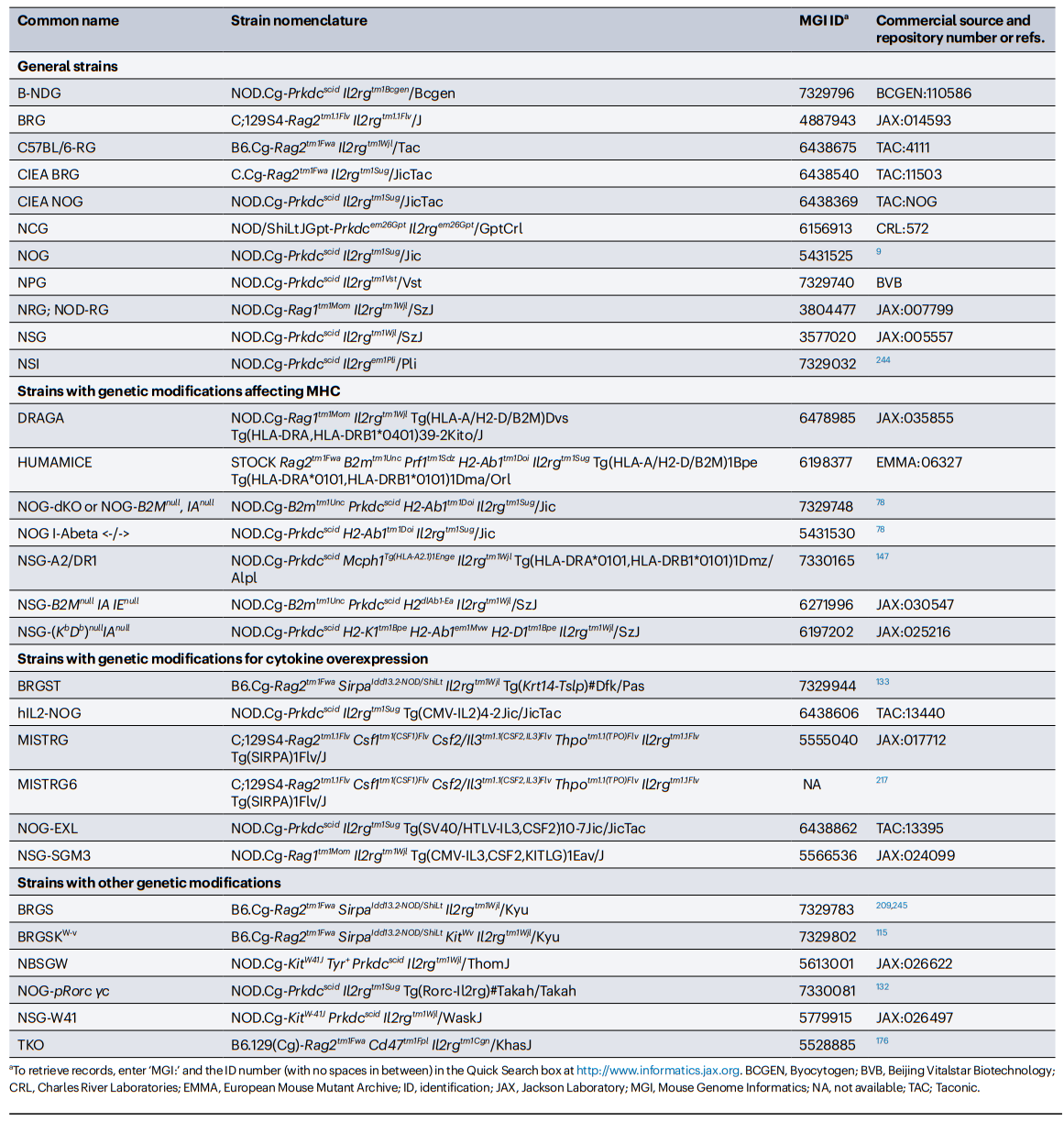
Hu-PBL-SCID模型的一个关键特征是植入的人T细胞群体在这些小鼠中介导了急性异种移植物抗宿主病(GVHD)(图1)。在小鼠模型中,GVHD的发展动力学取决于几个因素,包括预处理方案的使用(如辐射),其加速植入,以及注射的PBMCs的数量,这与由此产生的人类细胞嵌合体水平直接相关。T细胞介导的GVHD是致命的,并限制了在标准免疫缺陷小鼠身上进行实验的时间框架。Hu-PBL-SCID模型是测试抑制人T细胞反应的药物的有效平台,包括基于抗体的治疗,基于Treg细胞的治疗和细胞因子。人T细胞在Hu-PBL-SCID小鼠中的反应主要针对小鼠的MHC分子。编码小鼠MHC I类(重链H2-K、H2-D和β2m)和II类(H2-IA和H2-IE)分子的基因在NSG小鼠和NOG小鼠中失活,导致NSG-MHC-DKO和NOG-dKO模型。所有这些模型都限制了GVHD发生,因此可以在延长的时间窗口进行实验。HUMAMICE是另一种GVHD降低的小鼠模型,是在C57BL/6背景下建立的,该模型缺乏Rag2、IL2rg、Perf(编码穿孔素)、B2M和IA,并表达HLA-A2和HLA-DR1。将HLA-A2+和HLA-DR1+的PBMCs植入HUMAMICE中,可使人的CD4+、CD8+T细胞和CD19+B细胞在无移植物抗宿主病的情况下发育,并产生强大的抗原特异性抗体反应。然而,关于MHC缺陷小鼠的一个重要考虑是,小鼠IgG受体FcRn大亚基p51的表达需要B2M,这增加了循环中IgGs的半衰期。因此,缺乏B2M的NSG小鼠的人IgGs半衰期显著低于NSG和NSG-缺乏KbDb小鼠,这可能直接影响该模型中基于抗体的方法的有效性。在另一项研究中,将PBMCs植入表达IL4的NOG小鼠体内,导致主要T细胞表型从CD8+T细胞转变为CD4+T辅助2细胞,抑制了GVHD的发生,并能够产生抗原特异性的IgG反应。
抗PD-1抗体可以限制移植了异基因PBMC的NOG-dKO小鼠中人类淋巴瘤或胶质母细胞瘤细胞系的生长。一项研究中,STAT3的小分子抑制剂促进了人CD8+T细胞在NOG-dKO小鼠体内的肿瘤渗透,并抑制了人胶质母细胞瘤CDX的生长。出乎意料的是,在NOG-dKO小鼠中,与单独使用任何一种药物相比,相同的STAT3抑制剂和抗PD-1抗体的组合增强人类免疫细胞的肿瘤渗透和抑制肿瘤生长的能力有所降低。最后,针对人B7-H4和CD3的双特异性抗体促进了活化的CD8+T细胞的肿瘤渗透,并减少植入了乳腺癌细胞系和同种异体PBMCs的NSG-MHC-DKO小鼠的肿瘤生长。
Hu-PBL-SCID小鼠的CAR疗法
在过去的几年中,许多研究表明,在各种Hu-PBL-SCID模型中,基于CAR-T细胞的方法抑制肿瘤细胞的生长。例如,靶向HER2的CAR-T细胞在hIL2NOG中显示出对黑色素瘤细胞的疗效。此外,CAR-NK细胞策略还证明了来自诱导多能干细胞(iPSCs)的NK细胞具有抗肿瘤作用。来自iPSCs的NK细胞在NSG小鼠中显示出强大的肿瘤特异性细胞毒活性,并在Hu-PBL-SCID模型中促进T细胞对肿瘤的侵袭。使用来自癌症患者的iPSCs来产生人类免疫细胞和造血干细胞和祖细胞(HSPCs),可以提供无限数量的这些细胞群,用于植入携带自体肿瘤的人源化小鼠,并为新疗法的测试提供新的平台。
Hu-SRC小鼠
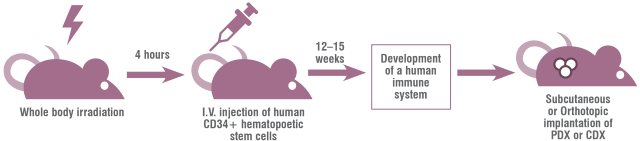
将人CD34+HSPC植入免疫缺陷小鼠,产生了人SCID再生细胞(Hu-SRC)小鼠,其具有比Hu-PBL-SCID小鼠更完整的造血系统,包括天然免疫细胞、适应性免疫细胞以及低数量的红细胞和血小板。在引入含有IL2rg基因突变的免疫缺陷小鼠之前,移植CD34+HSPC并实现高度人类免疫细胞嵌合以发展功能性先天免疫细胞和获得性免疫细胞的能力受到限制。例如,NOD-SCID小鼠可以移植CD34+HSPC,但其骨髓中CD34+细胞的水平非常低,导致人类外周免疫系统的有限和可变发展。CD34+HSPC最容易和最可靠的来源是脐带血(UCB),也可以从G-CSF(也称为CSF3)、胎肝组织和骨髓动员的外周细胞获得。影响CD34+HSPC植入免疫缺陷小鼠的参数有多种,包括品系的遗传背景、受体的年龄、CD34+HSPC的来源、注射途径、注射CD34+HSPC的数量以及所采用的预处理方案。此外,研究人员提出,CD34+HSPC的来源影响移植小鼠中人T细胞的功能,胎儿CD34+HSPC产生的T细胞比成人来源的CD34+HSPCs104产生的T细胞具有更强的免疫耐受性。CD34+HSPC移植到SCID小鼠可以同时产生固有和适应性细胞系(图1);然而,将CD34+HSPC植入标准的NSG、NRG(Rag1和IL2rg基因敲除)、NOG和BRG模型有几个限制,例如①成熟的人固有细胞系(单核细胞、巨噬细胞、DC和NK细胞)的不完全发育;②人B细胞的整体功能有限(产生抗原特异性IgG并经历类别转换和亲和力成熟的能力降低);以及③缺乏HLA表达,这是发展HLA受限的T细胞所必需的。在CD34+HSPC植入后,在免疫缺陷小鼠品系中引入了一些遗传改变,以增强人类免疫系统的发育和功能(表1)。
CD34+HSPC移植到SCID小鼠体内后存活的一个关键因素是宿主的预处理需要耗尽内源性免疫细胞。标准方案包括照射或用烷化剂(如busulfan)处理。此外,由于引入了遗传改变,如Kit基因内的突变,已经产生了几个不需要预处理的新的免疫缺陷小鼠品系,Kit基因座编码一种与KIT配体(也称为SCF)结合的受体酪氨酸激酶,在造血中具有关键作用。将小鼠暴露在抗KIT抗体下,可以瞬间植入CD34+HSPC和免疫系统嵌合体,而不需要辐射预处理;这种表型在携带KIT突变的小鼠中持续存在。例如,携带KitW41J突变的NSG小鼠(NSG-W41)可以移植CD34+HSPC并在不受辐射的情况下发展人类免疫系统;此外,与受辐射的NSG小鼠相比,它们还增强了人类髓系分化、人类红细胞生成和血小板生成。与未转基因的NSG-W41小鼠相比,人IL-7在NSG-W41小鼠中的转基因表达促进了CD34+HSPC移植后外周血中功能性人T细胞的扩增。将C57BL/6J-KitW41J小鼠与标准NSG小鼠杂交,获得了非白化NBSGW小鼠,在无照射的情况下也能植入CD34+HSPC并发育免疫系统。与NSG小鼠相比,NBSGW小鼠的红细胞生成能力有所改善。将携带KitWv功能缺失突变的C57BL/6J-KitWv小鼠与缺乏Sirpa的BRGS小鼠(编码CD47受体SIRPα)杂交。在CD34+HSPC植入后,所产生的小鼠模型BRGSKWv不需要辐射来发展人类免疫系统,并且与BRGS小鼠相比,它增强了人类的红细胞生成和血小板生成。
Hu-SRC小鼠的免疫肿瘤学研究
Hu-SRC小鼠已经被用来评估TME(包括浸润性免疫细胞的表型和功能,以及与肿瘤细胞的空间关系)和免疫疗法的抗肿瘤活性。考虑到从癌症患者获取自体骨髓或G-CSF和/或GM-CSF动员的外周血样本的挑战,大多数Hu-SRC模型是同种异体移植,尽管有几个小组产生了自体移植Hu-SRC模型(表3)。在一项研究中,两名转移性黑色素瘤患者的肿瘤组织被用来建立PDX模型,并从同一患者的血液中分离出自体CD34+HSPC(在用G-CSF从骨髓中动员这些细胞后)。尽管人类CD45+细胞的数量在不同的受体小鼠之间有所不同,但移植了自体CD34+HSPC的小鼠的肿瘤生长相对于未移植的小鼠和移植了不匹配的同种异体CD34+HSPC的小鼠(来自UCB)来说是延迟的。此外,这种延迟与肿瘤对人类免疫细胞的侵袭增加有关。另一种基于转基因CD34+HSPC的方法被用于建立AML的自体移植人源化小鼠模型。CD34+HSPC被转导到编码NPM1突变形式的慢病毒载体(约30%的成人AML患者中检测到这种变化),植入这些工程CD34+HSPC的NSG小鼠同时发展了人AML和功能免疫系统。在该自体移植模型中,与接受磷酸盐缓冲盐水的小鼠和接受双特异性T细胞结合并使用抗CD3抗体的小鼠相比,针对CD3和CD123的双特异性T细胞结合蛋白导致CD123+白血病启动细胞耗尽。另一种【Induction of WT1-specific human CD8+ T cells from human HSCs in HLA class I Tg NOD/SCID/IL2rgKO mice】模拟自体免疫系统和肿瘤异种移植之间相互作用的方法涉及建立人源化的小鼠模型,该模型带有表达HLA限制性肿瘤特异性抗原的TCR。该模型的一个例子是在表达HLA-A24的NSG小鼠身上开发的,小鼠被植入了HLA匹配的CD34+HSPC,这些细胞是通过慢病毒载体转导的,该慢病毒载体编码针对WT1抗原的HLA-A24限制性TCR。在这些小鼠中,MHC-Tetramer染色显示胸腺和外周有WT1特异性CD8+T细胞的发育。这些CD8+T细胞对WT1多肽有反应,并对WT1+白血病细胞株表现出细胞毒作用。尽管自体移植Hu-SRC小鼠模型为研究免疫细胞和肿瘤之间的相互作用提供了一个很有前途的平台,但它们构成了巨大的技术和挑战,而且范围有限。
同种异体移植Hu-SRC小鼠模型也被用于研究人类免疫系统与肿瘤的相互作用,并测试免疫疗法。在一项研究中,来自一系列肿瘤类型的10种不同的CDX被植入同种异基因UCB CD34+HSPCs的NSG小鼠。所有10种CDX都在移植的小鼠中生长,在所有肿瘤中都能检测到人类CD45+免疫细胞的浸润物;然而,浸润性细胞的数量在不同的肿瘤之间有很大的不同,导致其中一些细胞被归类为“热的”或“冷的”,这取决于浸润性的程度。免疫浸润物的成分似乎是肿瘤类型特异性的,不受HSPC供体因素的影响。在这10个CDX模型中的6个中,抗PD-L1抗体减少了肿瘤的生长,这种减少在分类为“热”或“冷”的肿瘤中都观察到了。移植CD34+HSPC的同种异体NSG小鼠也支持PDX的生长,包括肺癌、乳腺癌、膀胱癌或肉瘤患者的标本。在一项研究中,来自这些肿瘤类型的7种PDX在移植CD34+HSPC的NSG小鼠中产生,其生长动力学与未植入NSG小鼠的生长动力学相似。人CD45+细胞在Hu-SRC小鼠中被检测到,尽管CD45+细胞的数量在每种PDX模型中不同,并且对特定的HSPC供体也观察到不同的反应。此外,暴露于抗PD-1抗体可延缓这7个PDX中的4个的生长,尽管其效果因CD34+HSPC供体而异。在同一项研究中,耗尽人CD8+T细胞(使用人特有的抗CD8抗体)在三阴性乳腺癌(TNBC)CDX中消除了抗PD-1抗体的生长抑制活性,表明CD8+T细胞是ICIs效应的关键介质。有趣的是,PDX肿瘤和CD34+HSPC供者之间的HLA配型水平并不影响抗PD-1抗体的生长动力学或效果。另一项研究还表明,在植入CD34+HSPC的NSG小鼠TNBC CDX模型中,抗PD-1抗体的抗肿瘤活性延长。其他研究表明,同种异体移植Hu-SRC小鼠模型可用于研究ICIs在肺癌PDXs和CDXs、肝细胞癌PDXs和CDXs、卵巢癌CDXs、去分化脂肪肉瘤PDXs和TNBC PDXs和CDXs中的活性。
克服Hu-SRC小鼠的局限性
尽管利用Hu-SRC小鼠在免疫肿瘤学研究中取得了实质性进展,但对数据集的解释仍然具有挑战性。用于移植的CD34+HSPC供体的多样性影响肿瘤的生长模式和ICIs的疗效。此外,在Hu-SRC小鼠中,ICIs并不总是对某些肿瘤模型的PDX具有活性,临床上表现出反应的恶性肿瘤最常观察到治疗效果。然而,同一肿瘤类型的不同PDX中的活性可以是不同的。虽然这些挑战可以通过肿瘤和CD34+HSPC供者之间的内在差异来解释,但人源化小鼠模型的局限性也可能起到作用。
携带IL2rg突变的免疫缺陷小鼠会损害淋巴组织诱导物(LTi)细胞的发育,从而限制淋巴结构的发育。这一特征被认为是导致Il2rgnull小鼠在植入CD34+HSPC后无法产生强大抗体反应的关键因素。在过去的几年里,两个研究小组已经产生了人源化的小鼠模型,改善了淋巴结的发育。其中一种模型是基于内源性Rorc启动子控制下的NOG小鼠IL-2rg的表达,从而能够在LKi中表达IL-2Rγ亚基(几种白介素受体共有的亚基)。与NOG小鼠相比,经CD34+HSPC移植的NOG-pRorc-γc小鼠具有更多的小鼠LTi细胞数量和更好的淋巴结构生成。另一种模型是基于Krt14启动子控制下的小鼠胸腺基质淋巴生成素(TSLP)在BRGS小鼠中的表达,该模型被称为BRGST。TSLP是一种由上皮细胞分泌的细胞因子,在功能和结构上与IL-7相似,并与包含IL-7Rα链和TSLPR的异二聚体受体结合。TSLP的功能最初是在IL7缺陷的免疫活性小鼠中表现出来的,在这些小鼠中TSLP的转基因表达恢复了LTi细胞的生成和淋巴结的发育。与BRGS小鼠相比,CD34+HSPC移植后BRGST小鼠的淋巴结和胸腺结构发育明显改善,滤泡辅助性T细胞百分率增加,产生抗原特异性抗体和T细胞反应增加。
HU-SRC小鼠中HLA的表达
在过去的几年里,已经产生了几个表达HLAI类和II类分子的新的小鼠模型。在Hu-SRC小鼠中,人类T细胞的发育发生在小鼠的胸腺中,因此,胸腺细胞学习主要是由小鼠的MHC驱动。在众多研究中,在人源化小鼠模型中转基因表达HLAI和/或II改善了人CD8+和CD4+T细胞的发育和存活,从而增强了抗原特异性免疫反应。将表达HLA-A2和HLA-DR1(NSG-A2/DR1)的NSG小鼠移植到与其匹配的CD34+HSPC后,感染编码丙型肝炎病毒衍生蛋白NS3的腺病毒,与感染的NSG小鼠相比,可产生抗原特异性的、受HLA-A2限制的CD8+T细胞反应、NS3和腺病毒的中和抗体水平以及病毒清除。NSG-A2/DR1也具有部分控制肝脏病毒载量的能力。与NRG 小鼠相比,表达HLA-A2和HLA-DR4(DRAGA)的NRG小鼠移植了匹配的CD34+HSPC后,增强了人T细胞和B细胞的功能,并产生了更强的抗原特异性CD8+T细胞反应。移植CD34+HSPC的DRAGA小鼠已被用于其他病原体的研究,包括恶性疟原虫、流感病毒和Orientia tsutsugamushi。用人类免疫缺陷病毒(HIV)衍生多蛋白的改良痘苗病毒Ankara载体免疫BRGS小鼠后,表达HLA-A2和HLA-DR2的BRGS小鼠可以加速人T细胞的发育,促进功能T细胞和B细胞的发育,并能够产生抗原特异性T细胞和IgGs。
该模型在Hu-SRC小鼠体内的表达及其与HLA型相合的肿瘤和CD34+HSPC的植入,为该模型在免疫肿瘤学研究中的应用奠定了基础。然而,在许多情况下,实现移植的免疫系统和移植的肿瘤之间的完全匹配是具有挑战性的;因此,防止肿瘤移植后同种异体反应性T细胞的激活仍然是困难的。
BLT小鼠
Hu-SRC模型的一个缺点是缺乏用于基于HLA的学习和选择人T细胞群体的人胸腺上皮。也许最完整、也是最复杂的人类免疫植入方法包括将人胎肝CD34+HSPC和自体胎儿胸腺组织植入SCID小鼠体内,产生一种被称为骨髓、肝脏、胸腺(BLT)或Thy/Liv的模型。这种方法使人类胸腺样结构的生长能够支持HLA限制的T细胞的发展。BLT模型是从SCID-Hu模型发展而来的,该模型是为研究HIV感染而开发的,包括将人胎儿胸腺组织植入CB17-SCID小鼠的肾被膜下,同时静脉注射自体胎肝细胞。通过将自体胎肝片段与胸腺共同植入肾被膜下,并注射胎肝来源的CD34+HSPC,改进胸腺移植方案,产生BLT小鼠模型。该模型已被用于研究胸腺内人T细胞的选择,并为胸腺生成和自身反应性T细胞的阴性选择提供了功能上的见解。此外,BLT小鼠支持人类外周T细胞的稳健发展,包括常规的CD4+和CD8+T细胞以及功能强大的CD4+Treg细胞。然而,人B细胞和先天免疫细胞的功能和成熟状态在BLT小鼠中仍然有限。多项研究表明,BLT小鼠可以按照初始免疫方案产生人T细胞反应,并在感染艾滋病毒、登革热病毒或Epstein-Barr病毒后产生T细胞反应和有限的抗体反应。GVHD样消瘦综合症的发展大大缩短了BLT小鼠的寿命,这是与该模型相关的问题。这种综合征的发展在不同的实验室和特定的SCID小鼠品系之间是不同的。值得注意的是,在C57BL/6 Rag2null-Il2rgnull-Cd47ull背景上产生的BLT小鼠不会患上GVHD样综合征,并已被用于研究长期感染和产生对HIV的免疫。然而,在大多数BLT模型中,人类胸腺器官环境的存在似乎促进了慢性GVHD的发展,但C57BL/6 Rag2null-Il2rgnull-Cd47ull小鼠除外,导致移植后约15周的组织炎症和纤维化。此外,在可获得足够的移植组织方面的限制使BLT模型难以在大规模研究中实施。
与产生和使用BLT小鼠相关的挑战,包括生存手术的需要,移植组织的获取以及GVHD样消瘦性疾病的发展,限制了该模型在人类免疫肿瘤学研究中的应用。两个研究小组使用NSG-BLT模型验证了慢病毒载体转导人胎肝CD34+HSPC的有效性,慢病毒载体编码黑色素瘤相关抗原MART-1的HLA-A2限制性TCR,以及该MART-1-TCR随后在体内人CD8+T细胞中的表达。这两项研究都表明,在NSG-BLT小鼠体内表达MART-1-TCR的CD8+T细胞可以控制移植的HLA-A2+黑色素瘤的生长【Human melanoma immunotherapy using tumor antigen-specific T cells generated in humanized mice】。NSG-BLT小鼠也被用来证明体外激活的人NK细胞对低分化的人口腔鳞癌干细胞的抗肿瘤活性。另一项研究表明,人脐血来源的间充质干细胞不会损害NSG-BLT小鼠控制注射转化的人成纤维细胞所产生的肿瘤生长的能力。NSG-BLT小鼠也被用来在存在自体免疫系统的情况下模拟人类白血病细胞的生长。这个模型是通过转导胎肝CD34+HSPC和MLL-AF9建立的,MLL-AF9是在一些人类白血病中检测到的融合基因,导致B细胞急性淋巴细胞性白血病的自发发展。
人源化模型的现状
选择最合适的小鼠模型是优化人源化小鼠研究转化潜力的一个重要考虑因素。不幸的是,没有单一的人源化小鼠概括了TME中免疫格局的方方面面。需要仔细考虑和评估生成人源化小鼠模型的复杂性和每个特定模型的局限性,以确保有效研究的最高概率。在设计人源化小鼠实验时应考虑几个参数。
植入策略与感兴趣的免疫细胞
免疫肿瘤学研究的植入策略的选择应以正在评估的治疗为指导。例如,基于CAR的细胞疗法的活性传统上是使用来自外周血的成熟免疫细胞来评估的。分离包括T细胞和NK细胞在内的单个免疫细胞亚群,设计表达CAR的基因,然后注射到携带肿瘤的免疫缺陷小鼠体内。在过去的几年里,技术的发展使得从CD34+HSPC移植的小鼠中分离出人类免疫细胞(包括T细胞、NK细胞和髓系细胞)用于CAR结构的转导。考虑到在Hu-PBL小鼠中,CD4+和CD8+T细胞都是主要的CD45+亚群,利用人T细胞的免疫疗法可以在这些模型中有效地测试,尽管在PBMC植入后,人类的CD4+Treg细胞通常并不丰富。T细胞导向疗法也可以在Hu-SRC或BLT小鼠身上进行测试,但需要考虑这些模型中T细胞发展的动力学(图1)。Hu-SRC模型还支持B细胞和先天免疫细胞亚群的发展,这可以作为治疗的靶点。
小鼠品系的选择
特定造血系的发育和存活也将直接受到移植的免疫缺陷小鼠品系表达的细胞因子和生长因子的影响。这一点对实验的成功至关重要,应该决定使用哪种小鼠品系以及植入方案。人细胞因子在Hu-SRC模型中的表达促进了先天性免疫细胞的发育,这导致了这一领域的显著进展(表1)。有几个模型,包括MISTRG、NSG-SGM3、NOG-EXL(表达GM-CSF和IL-3)和基于FLT3L的模型,支持人类髓系发育,是研究肿瘤相关巨噬细胞和DC的有前途的模型(表1)。在表达IL15的小鼠和MISTRG小鼠中,NK细胞的发育、存活和功能显著增强。在自体移植模型中,功能性人类T细胞的发育可以得到极大的改善(表1)。表达IL6的人源化模型显示了改善B细胞功能和促进先天免疫细胞发育的前景,因此可能成为研究肿瘤特异性抗体反应和抗体依赖的细胞吞噬作用的有用工具
选择人源化小鼠模型时需要考虑的其他参数包括:①植入后感兴趣的免疫细胞的功能是否得到验证;②来自合作者或商业来源的小鼠品系的可用性;以及③移植小鼠的寿命。所有这些因素将决定一种实验方法的可行性及其在评估免疫疗法方面的转化潜力。最后一个建议是对选定的小鼠模型进行试验性验证实验,以确认它适合计划的研究。
未来方向
讨论的大多数实验方法都依赖于使用不匹配的肿瘤和免疫系统。这些同种移植肿瘤模型(表3)已成功地用于表征人类免疫细胞渗入TME和研究免疫系统与肿瘤的相互作用。用于建立同种异体移植模型的资源非常丰富,包括HSPC和患者来源的癌症标本;然而,即使捐赠者的免疫细胞和肿瘤之间存在部分HLA匹配,肿瘤也将被识别为同种异体。此外,由于HLA不匹配和缺乏支持T细胞发育的人胸腺上皮,HLA限制性肿瘤抗原特异性T细胞的产生是具有挑战性的。与同种异体移植模型相比,自体移植肿瘤模型(表3)具有几个优点,可以潜在地产生HLA限制的、肿瘤抗原特异性的T细胞反应,并能更真实地再现患者的表型和治疗反应。自体移植的Hu-SRC模型需要存在HLAI类和II类分子,以实现T细胞的最佳发育和功能。自体模型的一个重要障碍是血液淋巴细胞和HLA相合的肿瘤标本的可获得性有限。从患者分离的CD34+HSPC移植小鼠的另一个限制是需要大量的HSPC来稳健发展人类免疫系统。减少CD34+HSPCs植入障碍的免疫缺陷小鼠的产生,包括携带Kit突变(如KitW41J)小鼠和MISTRG小鼠,可以更有效地植入这些细胞。患者来源的CD34+HSPC的使用也将使评估患者对包括基因治疗在内的治疗干预措施的具体反应成为可能。采集HLA匹配的肿瘤样本和血液淋巴样细胞需要适当的基础设施和监督(图2)。目前,大多数现有的人源化模型缺乏成熟的人中性粒细胞,而中性粒细胞在癌症中具有重要作用。在缺乏CSF3R的MISTRG小鼠中,用CSF3替换编码G-CSF的Csf3促进了人中性粒细胞的发育。支持中性粒细胞植入的人源化模型的进一步发展将为研究粒细胞在肿瘤生物学中的作用提供独特的工具。
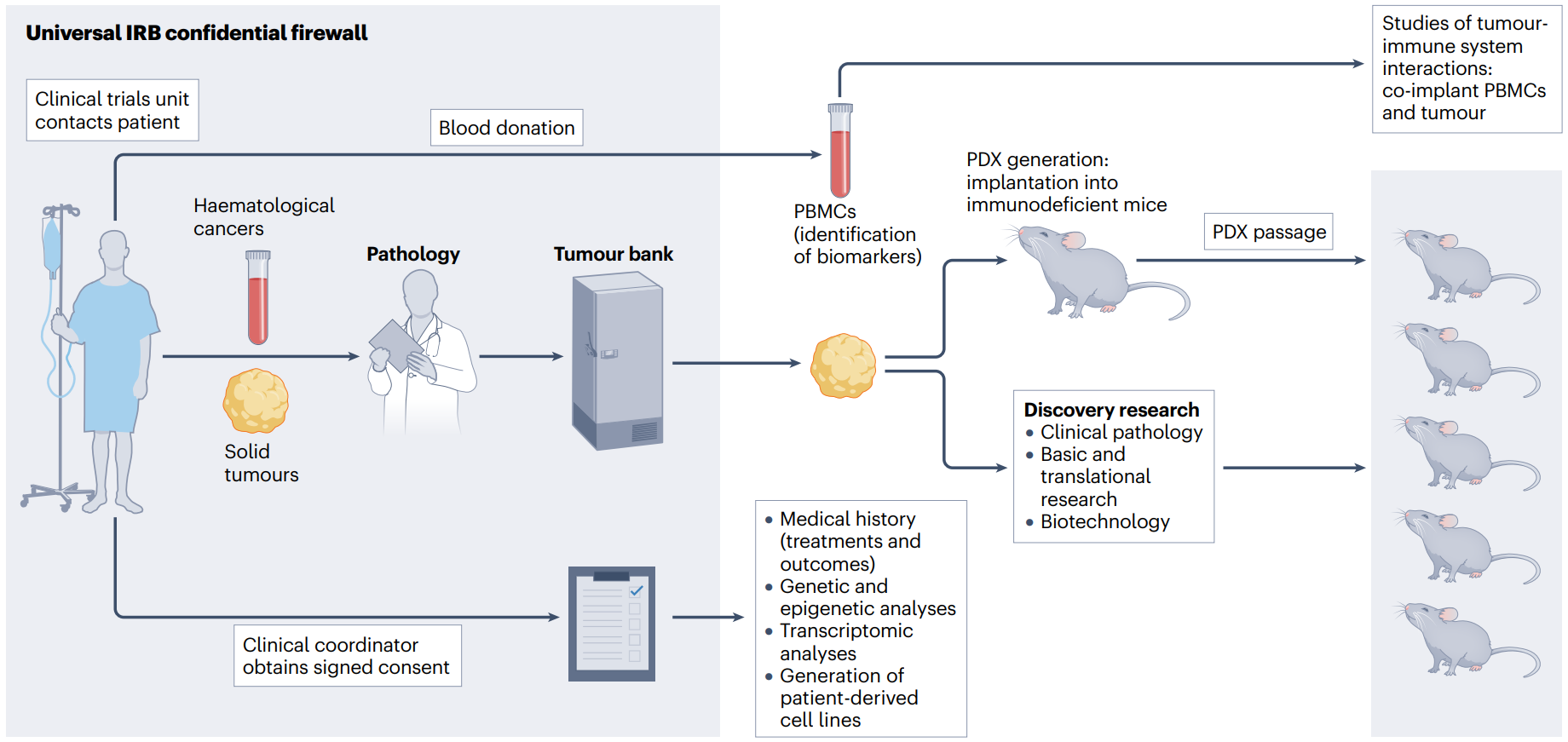
图2
尽管用于免疫肿瘤学研究的人源化小鼠的发展取得了实质性进展,但这些模型仍然存在局限性。越来越多的研究证明,目前可用的人源化模型是研究免疫细胞群在体内限制肿瘤生长的能力和评估癌症患者各种免疫疗法的有用工具。然而,这些疗法在人源化小鼠中的效果是不同的,关于这些观察结果的转化潜力仍然存在问题。在人源化小鼠模型的开发方面的进展将有助于提高人源化小鼠在免疫肿瘤学研究中的转化潜力。
Morillon, Y. M. et al. The development of next-generation PBMC humanized mice for preclinical investigation of cancer immunotherapeutic agents. Anticancer Res. 40, 5329–5341 (2020).
Jangalwe, S., et al. Improved B cell development in humanized NOD-scid IL2Rγnull mice transgenically expressing human stem cell factor, granulocyte-macrophage colony-stimulating factor and interleukin-3. Immun. Inflamm. Dis. 4, 427–440 (2016).
Voillet, V. et al. An in vivo model of human macrophages in metastatic melanoma. J. Immunol. 209, 606–620 (2022).
Ho, N. et al. In vivo generation of CAR T cells in the presence of human myeloid cells. Mol. Ther. Methods Clin. Dev. 26, 144–156 (2022).
Chuprin, J., et al. Humanized mouse models for immuno-oncology research. Nat Rev Clin Oncol 20, 192–206 (2023).
Hu, Z., Xia, J., et al. Human melanoma immunotherapy using tumor antigen-specific T cells generated in humanized mice. Oncotarget 7, 6448–6459 (2016).
Jing, R. et al. EZH1 repression generates mature iPSC-derived CAR T cells with enhanced antitumor activity. Cell Stem Cell 29, 1181–1196.e6 (2022).
不感兴趣
看过了
取消

人点赞

人收藏

打赏
不感兴趣
看过了
取消




您已认证成功,可享专属会员优惠,买1年送3个月!
开通会员,资料、课程、直播、报告等海量内容免费看!

打赏金额
认可我就打赏我~
1元 5元 10元 20元 50元 其它
打赏作者
认可我就打赏我~
扫描二维码
立即打赏给Ta吧!
温馨提示:仅支持微信支付!
已收到您的咨询诉求 我们会尽快联系您
