
大量证据支持了过量草酸盐在破坏草酸盐摄入、生产和排泄之间平衡时的病理作用。
Ermer T, Nazzal L, Tio MC, Waikar S, Aronson PS, Knauf F. Oxalate homeostasis. Nat Rev Nephrol. 2023 Feb;19(2):123-138. doi: 10.1038/s41581-022-00643-3. Epub 2022 Nov 3. PMID: 36329260; PMCID: PMC10278040.
通过内源、外源供给和体内排泄之间的微妙平衡来维持草酸的平衡。新的研究揭示了代谢途径的重要作用,微生物群,上皮草酸转运蛋白,以及充足的草酸排泄物,以维持草酸的平衡。在原发性或继发性高氧肝病、肾结石、急性或慢性草酸肾病或不论病因的慢性肾病患者中,这些元素中的一种或多种都被破坏。随之而来的草酸体内平衡的损害会引发局部和全身的炎症、进展性肾病和心血管并发症,包括心脏猝死。虽然肾置换治疗是控制需要透析的肾功能衰竭患者血浆草酸盐浓度升高的标准方法,但需要进行更多的研究,以确定在肾脏疾病早期阶段有效的消除策略。除了众所周知的干预措施(如饮食修饰)之外,新的治疗方法(如小干扰性RNA基因消音器、重组氧化盐降解酶和氧化盐降解细菌菌株)有望改善与氧化盐相关疾病的患者的视野。此外,实验证据表明,抗炎药物可能是缓解或解决氧化盐引起的疾病的另一种方法。需要进行更多的研究,以确定在肾脏疾病早期阶段的有效消除战略。除了众所周知的干预措施(如饮食修饰)之外,新的治疗方法(如小干扰性RNA基因消音器、重组氧化盐降解酶和氧化盐降解细菌菌株)有望改善与氧化盐相关疾病的患者的视野。此外,实验证据表明,抗炎药物可能是缓解或解决氧化盐引起的疾病的另一种方法。需要进行更多的研究,以确定在肾脏疾病早期阶段的有效消除战略。除了众所周知的干预措施(如饮食修饰)之外,新的治疗方法(如小干扰性RNA基因消音器、重组氧化盐降解酶和氧化盐降解细菌菌株)有望改善与氧化盐相关疾病的患者的视野。此外,实验证据表明,抗炎药物可能是缓解或解决氧化盐引起的疾病的另一种方法。重组氧化盐降解酶和氧化盐降解菌株)为改善与氧化盐相关疾病的患者前景提供了希望。此外,实验证据表明,抗炎药物可能是缓解或解决氧化盐引起的疾病的另一种方法。重组氧化盐降解酶和氧化盐降解菌株)为改善与氧化盐相关疾病的患者前景提供了希望。此外,实验证据表明,抗炎药物可能是缓解或解决氧化盐引起的疾病的另一种方法。
导言
草酸盐,一种看起来不明显的二羧酸,是20种尿毒症毒素中最多的一种。1 .通过供应、代谢途径和排泄的复杂相互作用(Fig. 1 )。因此,草酸盐的稳定性会受到许多因素的干扰。遗传突变会破坏内源性草酸生物合成和运输,而膳食和微生物因素以及胃肠道疾病会影响草酸盐的吸收。肾脏疾病也会损害草酸盐的清除,从而使无害的低浓度代谢物成为一种严重的多系统威胁,可能影响人体的几乎每一个器官和组织,包括心血管系统。2 – 4.
Fig. 1 |草酸平衡。
A ,生理草酸盐的平衡。草酸的体内平衡是由供应(即,产生肝、膳食草酸盐的胃肠道吸收和循环草酸盐的管状再吸收)和排泄(胃肠道分泌和粪便草酸盐、肾小球过滤、管状分泌物和尿草酸盐)之间微妙的相互作用维持的。生理血浆草酸盐浓度1-5m对心血管系统没有已知的负面影响。 b,破坏草酸的平衡和高草血症的后果。草酸的稳定性可能会被许多途径的改变所扰乱。慢性肾疾病患者尿分泌减少,原发性高草酸血症患者的肝生成增加,肠性高草酸血症患者的胃肠道吸收增加,导致血浆中草酸浓度增加。当肾功能仍然足够高,使补充性草酸排泄在肾脏时,高草酸可以导致肾钙中毒、管状毒性和阻塞。肾排泄功能的丧失会导致草酸盐血浆过饱和,对心血管系统有严重的不良影响。高血浆草酸盐与心脏猝死、冠状动脉疾病、充血性心力衰竭和血管钙化有关。草酸盐也可以沉积在其他组织,如骨,甲状腺,脾脏和肺。
血清或尿中草酸浓度的增加与进展性肾病有关 5 , 6 心血管疾病 2 , 3 、细胞及全身炎症 7 – 9 .2021年的一项研究还确定,高浓度的血清草酸盐是接受透析的患者心脏猝死的一个新的危险因素。3 .例如,关于动脉粥样硬化发病机制的新的翻译研究结果 10 ,目前正在帮助将该领域从单纯的联系转向因果关系。关于草酸盐等尿毒症毒素的病理生理学的进一步发现可能有助于降低肾和心血管疾病患者高得令人无法接受的死亡率。随着多余草酸盐积累的临床意义的新证据的出现,理解草酸盐体内平衡的基本原理是至关重要的。例如,新的研究进一步确定了上皮运输蛋白和肠道微生物体在草酸盐调节中的重要作用。11 , 12 .
在本综述中,我们将研究草酸盐在体内的途径,强调核心机械步骤及其临床意义。这些信息将为讨论草酸盐积累的病理生理后果提供基础。我们还将考虑新的介入、药理和微生物方法,以预防、缓解或解决影响肾脏、心脏和其他器官的与氧化盐有关的疾病。
草酸盐来源和新陈代谢
草酸盐是草酸的离子化共轭基,草酸是最简单的二羧酸。 13 , 14 .草酸盐要么是内源性生产,作为代谢的最终产品,要么可以作为多种食物、饮料或化学品的组成部分而被摄取(Fig. 1a )。健康的个体通常保持血浆草酸浓度1-5m.值得注意的是,根据测量方法,"正常"血浆草酸盐的范围可能会有所不同;例如,一项研究报告称,高达11倍的浓度是正常的。15 – 17 .
根据对不同饮食草酸盐摄入量对尿草酸盐水平相对贡献的测量,肝草酸生物合成约占体内总草酸水平的50-80%。18 .来自氨基酸和碳水化合物代谢的大量分子已被确定或建议为草酸前体(Fig. 2和表1 )。例如,来自胶原分解代谢的羟丙氨酸在健康人体内对尿草酸盐的贡献约为15%。 19 .糖酸盐是另一种公认的草酸前驱体,通过过氧等位体代谢,估计对3%的氧化生成有贡献。 20 .进行中的非随机临床试验 13 C 2 -糖酸酯灌注,评估糖酸酯对健康个体草酸形成的贡献 21 .值得注意的是,虽然大多数细胞都认为存在着糖酸盐,但它的生物学作用还不完全确定。 22 .乙二醛是碳水化合物自氧化、脂质过氧化和蛋白糖化作用的产物,主要通过糖化酶系统对糖酸盐进行解毒。23 , 24 .报道了人红细胞和肝细胞中草酸的体外合成。 24 , 25 ,尽管随后的研究表明,这种途径在体内的作用可能不大 26 .由于糖尿病患者的乙二醛和草酸排泄物均升高,因此也有人认为乙二醛是肾结石、高草酸血症和糖尿病之间缺失的联系。23 , 27 .最后,甘氨酸是一种在生理条件下对尿草酸盐贡献5%的小型氨基酸。 28 (Fig. 2 )。其他氨基酸,如色氨酸、酪氨酸和苯丙氨酸,也是潜在的草酸前驱体,但估计对内源草酸的贡献很小 28 .
Fig. 2 |内源草酸盐合成途径模型。
糖氧盐连接着几个代谢途径,被认为是健康人内源草酸盐的主要前体分子。糖化物来源包括羟丙氨酸 19 由胶原代谢而来,经线粒体三个步骤代谢为4-羟基-2-氧葡萄糖酸酯及其2,4-二-羟基葡萄糖酸酯(DHG);猪可由4-氢-2-氧葡萄糖酸钠酶1型(Hoga1)转化为糖苷酸。霍加1的缺乏导致原发性高氧血症3型,但这种情况下草酸积累的确切机理尚不清楚。4 .猪的积累可能会抑制普遍存在于胞质和线粒体中的甘氨酸还原酶/羟基丙酮酸还原酶,并将甘醛酸转化为糖酸盐;甘肽还原酶缺乏可引起P2。在过氧化物酶体中,氨基酸甘氨酸也被D-氨基酸氧化酶(DAO)转化为甘氨酸。肝特异性过氧性丙氨酸-甘氨酸转氨酶(ATT)的缺乏导致了P1的出现。除了甘氨酸,甘氨酸 22可以从乙二醛等来源得到,乙二醛是一种过氧化产物,通过糖酶系统转化为糖酸酯。其他一些过程也有助于形成糖酸盐,包括DNA修复(2-磷酸乙醇通过磷酸乙醇磷酸酶转化为糖酸)和果糖或乙二醇代谢(糖醛通过醛脱氢酶转化为糖酸)。然后由肝特异性过氧性糖酸氧化酶(go;又称好氧1)转化为乙氧基。甘氨酸通过肝特异性乳酸脱氢酶A(LDHA)转化为草酸。
Table 1 |内源和外源草酸盐的主要来源
虽然内源性的氧化生成还不完全了解,但许多途径在草酸乙酯的直接前驱体--甘氨酸中聚集 19 , 25 (Fig. 2 )。在生理平衡的状态下,糖醛酸被酶化转化为甘氨酸或糖酸盐。但是,过量的乙氧基酸被肝特异性乳酸脱氢酶A(LDHA)转化为草酸 19 , 20 .可以代谢为草酸的外源物质包括大量的维生素C补充剂或无色醇乙二醇 29 .非酸性条件下抗坏血酸与草酸的非酶转化使体外生物液体中草酸的测定复杂化。 30 .这个过程也可能导致接受维生素C补充剂的患者血浆草酸浓度升高。 30 .乙二醇由于其低冰点而常被用作防冻剂,它通常是以自杀的意图作为廉价的酒精替代品或儿童意外地摄入的。 31 .经胃肠道快速吸收后,大部分乙二醇在肝脏中通过醇脱氢酶代谢成甘醛,然后经过几个氧化步骤转化为草酸 31 (Fig. 2 )。乙二醇及其代谢物乙醇酸和乳酸的血浆和尿液浓度极高,导致严重的阴间隙酸中毒以及神经、心肺和肾脏损害 31 .

PH1, primary hyperoxaluria 1.
尽管生物利用率很低,只有5-15% 32 , 33 ,膳食草酸盐约占体内草酸盐总量的20-50%。18 , 34 (表1 )。世界不同地区的烹饪风格和饮食中,草酸的摄入量差别很大 29 , 35 .西方饮食中每天摄入100-200毫克(范围广泛),被认为对肾功能正常的患者是无害的。 29 , 36 .然而,许多研究已经报告了急性肾病的病例,这些病例是由摄入大量含高草酸的食物引起的(例如,喜树果)。29 .转运研究表明,生理吸收草酸盐主要发生在小肠(较小程度上发生在胃和结肠),并通过其他粪便成分的存在而改变。 37 .草酸盐是一种离子化共轭基,因此很容易与二价阳离子(如镁)络合。2+ 和卡 2+ 使草酸盐在粪便中结合,减少肠道吸收。14 , 37 .
根据放射性同位素标记草酸盐输注研究,估计90%草酸盐通过肾脏排出,不变。32 , 38 , 39 .由肾小球滤过和净小管分泌物(主要在近端小管内)联合维持每天10-40毫克(0.1-0.45毫克/天)的草酸分泌量。33 , 34 , 40 .只有一小部分内源草酸盐通过粪便排出 34 ,但在小鼠慢性肾病模型中,肠内草酸盐分泌量过高,这可能有助于预防高草血症。 11 , 41 , 42 .
上皮草酸处理
如前所述,血浆草酸盐来自代谢生产(主要在肝脏)和正常情况下摄入的膳食草酸盐的净胃肠道吸收。 14 , 37 , 43 .当肾功能正常时,草酸盐主要通过肾小球过滤和网管分泌通过肾排出。14 , 37 , 43 .因此,稳定的尿草酸排泄量与饮食草酸盐代谢生成量和净胃肠道吸收量的总和是平衡的。
草酸的上皮运输介导其吸收和分泌,并已使用几种方法来描述所涉及的运输途径。例如,用肾脏或肠道的膜泡研究,确定了顶部和基底外侧的膜阴离子交换活动,通过这些活动,草酸盐可以与氯离子等阴离子可逆交换。 − ,哦 − , HCO 3 − 、硫酸盐及甲酸盐 44 – 50 .随后,从溶质载体26(SLC26)和SLC4中发现克隆的转运蛋白以相同的阴离子交换方式介导草酸盐的迁移。尤其是sc26成员1(sc26A1)、sc26A2和sc26a6的功能表达 Xenopus 卵母细胞显示,每个溶质载体都能以高于基线的高速率介导草酸盐的摄取或流出 51 – 53 .功能表达研究还报告了通过SLC26A3、SLC26A5、SLC26A7、SLC26A8、SLC26A9和SLC26A11检测到草酸盐的转移(参考文献)。 54 – 57 );SLC4A1(亦称AAP1)及SLC4A2(亦称AAP2)亦可调解草酸盐的运输。 58 , 59 .值得注意的是,确定这些运输蛋白在大鼠体内通过上皮草酸运输和草酸平衡中的生理作用一直具有挑战性,但对淘汰小鼠的研究提供了一些见解。
胃肠道
吸入的草酸盐吸收于胃肠道的多个部位,包括胃、小肠和大肠 14 , 37 , 43 .重要的是,这种吸收依赖于其可溶性形式的可用性,因为不溶性草酸钙复合物的形成阻碍了草酸盐的吸收。 14 , 37 , 43 .草酸盐在胃肠道的吸收基本上是被动的(受卢门--------------------------------------水平的影响),并与食用可溶性草酸盐的量成正相关。 37 .草酸盐在胃中的跨细胞吸收是有可能的,这是由于非离子扩散穿过顶端膜(由极端腔内酸性驱动),但在肠道中,吸收似乎主要是对细胞的吸收,因为通过上皮草酸盐的渗透性与甘露醇的渗透性相似,甘露醇的渗透性是一个准细胞渗透性的标志,跨小鼠肠道的不同部分 60 .然而,在小鼠回肠和大肠的研究中,草酸盐净吸收是在无被动动力的情况下发生的,这一发现表明,跨细胞吸收也可能发生。 61 (Fig. 3 )。此外,还减少了组织中草酸的吸收通量。 Slc26a3 -空鼠,与野生型小鼠相比,减少尿草酸盐排泄量 61 .同样,在口服草酸盐负荷引起的高草酸血症的野生型小鼠中,SLC26A3小分子抑制剂显著降低了结肠中草酸盐的吸收,并对草酸盐喂养引起的尿草酸和草酸肾病有很大的减少。 62 .这些研究不仅显示了超细胞草酸盐吸收,而且还表明,它至少部分地依赖于顶端膜转运蛋白SLC26A3的表达和活性。然而,尽管SLC26A3的功能表达研究显示,其作为ccl的活力 − –HCO 3 − 交换机 63 ,从多种物种(包括人类)克隆而来的SLC26A3运输草酸盐的能力最多只能是有限的。54 , 57 , 63 , 64 .这些结果表明,SLC26A3可能只会促进草酸盐的吸收,因为它与其他在本地组织中存在但在报告的功能表达研究中没有与SLC26A3共同表达的转运蛋白相互作用。
Fig. 3 |小肠中的草酸盐转移。
大多数草酸盐吸收在小肠发生被动通过准细胞途径。跨细胞草酸盐分泌是由顶端膜cl介导的 − -草酸盐通过运输商溶质载体家族26成员6交换。基础外侧膜上的转运蛋白,与顶端的SLC26A6联合作用,在小肠中介导跨细胞草酸盐的分泌,至今尚未确定。
多个肠道段的跨细胞草酸盐分泌阻碍了草酸盐的吸收 37 .草酸盐分泌物在限制网草酸盐吸收中的重要性在小鼠小肠中得到了最清楚的证明。在肾脏、胰腺和小肠中表达的草酸盐顶膜转运蛋白SLC26A6具有强有力的cl活性。− -草酸交换剂,因此预测草酸在细胞膜之间的流动 51 , 52 , 65 .因此,十二指肠和回肠的草酸净分泌物 Slc26a6 -与野生小鼠相比,淘汰小鼠的数量大大减少 66 , 67 . Moreover, Slc26a6 -空鼠有高草血症,导致高草血症和尿路结石;泌尿道结石的发生依赖于老鼠。 66 , 67 .从饮食中去除草酸盐可以大大减少高草血症和高草血症。Slc26a6 -无效小鼠,表明过量尿草酸盐的来源主要是膳食 67 .这些发现支持了SLC26A6在通过紧密连接处被动吸收草酸盐的后端隔离中的作用(Fig. 3 )。此外,2021年的一项研究表明短链脂肪酸可以通过提高SLC26A6(Ref)降低尿草酸水平。 68 )。在CDH的鼠标模型中 11 ,粪便草酸排泄量随CDH的诱导而增加,提示肠道草酸分泌量可能会随肾排泄量的减少而增加,但在 Slc26a6 -无效小鼠,与野生型小鼠相比,CKD引起的高草血症加重 11 .值得注意的是,在缺乏SLC26A6的情况下,小鼠大肠内也会发生上皮层草酸盐分泌,这表明存在着草酸盐分泌的替代途径,至少在这个组织中 69 .肠道SLC26A6的表达与人体草酸体内的平衡有关,至今为止还只是传闻。在亚临床腹腔疾病且无脂肪吸收不良的患者中,高氧肝病与小肠中SLC26A6表达明显降低相关。70 而在另一个患者中,肠内高氧血症和肾结石则与优势阴性相关。 SLC26A6 突变 71 .淘汰小鼠的研究也证明了SLC26A6在唾液腺的草酸上皮分泌中的作用。 72 .
SLC26A1是一种碱性外侧硫酸盐-HCO 3 − -草酸阴离子交换剂,在包括肝脏、肾脏和肠道在内的多个组织中表达。52 , 73 – 77 .初次报告: Slc26a1 -白鼠有高草血症、高草血症和肾晶体沉积(类似于 Slc26a6 -空鼠)建议在肠道草酸盐分泌过程中可比较地参与SLC26A1和SLC26A6。78 .然而,随后的研究发现 Slc26a1 不损害肠道草酸盐分泌 79 , 80 但是减少尿草酸盐的分泌 80 .双等位基因的 SLC26A1 在两名草酸钙肾结石患者中发现了损害运输功能的突变(以硫酸盐通量测定),尽管只有一名患者患有高氧血症(轻微)。81 .因此,SLC26A1功能的丧失是否会引起肠道草酸分泌缺陷引起的严重的高草血症,仍然是高度不确定的。
肝细胞
除了胃肠道的可变表达外,肝和近端小管中均有SLC26A6和SLC26A1的表达。73 , 74 , 82 – 85 .在肝脏中,碱性外侧SLC26A1的动力学特性表明,它是代谢生成草酸盐流入血浆池的强候选介质。77 ,而顶部的SLC26A6可能有助于报告的草酸盐的胆管排泄 86 .然而,缺乏直接证据证明这些运输蛋白在肝细胞草酸转运中的作用。
肾
在肾脏中,草酸被过滤,然后在近端小管进行被动吸收和主动分泌,导致净分泌 40 , 87 .野生型小鼠肾草酸盐分泌量从&tt;1降至&l;1 Slc26a6 -空老鼠 88 .肾草酸盐分泌的缺陷 Slc26a6 -因此,无毒小鼠可被认为可降尿草酸盐。不过, Slc26a6 -无效小鼠有高草酸血症,这表明上述导致净草酸盐吸收增强的肠道草酸盐分泌缺陷导致足够的高草酸血症导致高草酸血症,即使尿草酸盐分泌减少。SLC26A1是一种可行的候选人,可以通过与顶端的SLC26A6联合调节草酸盐的基底外侧膜流入来实现近端小管内草酸的分泌。然而,SLC26A1的动力学特性可能使其无法在生理条件下调节草酸盐的大量流入。77 .尤其是基于六氯化氢的相对亲和力 3 − 而草酸盐与血浆浓度相比,SLC26A1预计将主要介导六氯化氢。3 − 而不是草酸盐流入,以换取近管内的胞内硫酸盐 77 .目前还没有直接证据表明SLC26A1在调节近端小管草酸盐分泌中的作用,尽管在小鼠体内观察到的尿草酸排泄量减少,但在全球淘汰小鼠中,可以观察到。 Slc26a1 (ref. 80 这可能暗示了肾草酸盐分泌的作用。
有趣的是,人类研究表明,在斋戒条件下,草酸盐的部分排泄量~1,表明很少或没有净分泌物,尽管在摄取草酸盐负荷后,出现可感知的快速净分泌物。89 .同样,在原发性高草酸血症(PH)导致血浆草酸盐升高的患者中,也观察到大量的净草酸分泌,但在没有PH的情况下形成结石的患者中则没有观察到。90 .肾草酸盐分泌对急性或慢性草酸盐负荷的作用机制仍有待确定。肾草酸盐处理的另一方面是近端小管外的经皮运输。例如,草酸盐的活性净吸收已被描述通过肾脏乳头上皮 91 .虽然这个过程可能不会实质上改变尿草酸盐的分泌,但它可能会调节草酸盐的局部间质浓度,从而影响晶体的形成。
值得注意的是,无论其作为草酸盐转运蛋白的作用如何,SLC26A6也可能是石头形成风险的重要修饰剂,因为它能够与柠檬酸转运蛋白NAD1(又称SLC13A2)相互作用并抑制其活动。92 .使出局 Slc26a6 导致NADC1活性增加,过滤后的柠檬酸的再吸收增加,尿柠檬酸的排泄减少,患钙肾结石的风险增加 92
微生物体在草酸盐体内平衡中的作用
数万亿的细菌在人体肠道中繁殖,并参与多种功能,包括膳食成分的新陈代谢。93 , 94 .人们日益认识到这些细菌对健康和疾病作出重要贡献。人类和其他哺乳动物缺乏代谢草酸盐的酶,因此依赖细菌降解来减少肠道草酸盐,从而可能减少其吸收 95 . 富士菌 是一种专业的草酸盐降解剂并诱导结肠内草酸盐分泌物 96 – 98 .流行病学数据将抗生素的使用与肾结石发病率的增加联系起来 99 , 100 ,以及对氧化盐降解微生物群的干扰可能是一个促成因素 101 .
在体外已经发现了大量的氧化盐降解微生物,但在体内每种微生物的相对重要性仍在争论中。102 .2021年的系统分析利用高通量的元基因组和元基因组数据来研究细菌草酸盐在体内的降解。研究表明,在健康的成年人体内,人体肠道微生物群包括一个多样化的群体,它们积极转录氧化降解基因。12 .在健康的个体中,草酸盐的降解主要由 O.福米奇尼斯 ,在转录水平上代表最大的草酸代谢基因储存库,比所有其他草酸降解生物的总和都要大,包括 大肠杆菌 , 双歧杆菌 特别方案。和乳酸菌特别方案。12 (Fig. 4).
Fig. 4 |草酸盐平衡的微生物调制。
食用草酸盐被几种肠道微生物降解,可减少可用于肠道吸收的草酸盐的数量。几种细菌可以降解草酸盐,包括 富士菌 , 大肠杆菌 , 双歧杆菌 特别方案。和 乳酸菌 特别方案。O.福米奇尼斯 也会释放出一种刺激肠道草酸分泌的分泌物。目前正在开发几种微生物疗法,以提高草酸盐的降解,减少草酸盐在胃肠道的吸收。这些治疗方法包括补充氧化盐降解菌群,使用草酸脱羧酶代谢草酸盐,以及使用 E. coli 尼塞尔菌株,它被基因改造来编码草酸盐降解途径基因编码的氧化炭-可可脱羧酶( 奥克斯达 )及草酸可可转移酶( 纤维素 ).
大多数将草酸微生物代谢与疾病联系起来的研究是通过比较形成肾结石的个体的肠道微生物群和健康个体的肠道微生物群 103 – 105 .例如,对粪便培养物的分析表明, O.福米奇尼斯 形成石头的个体比健康个体要低 106 ,但这个发现与后来使用微生物组测序数据的研究不一致 107 , 108 .将形成结石的个体肠道微生物群与同居的健康成年人肠道微生物群进行比较后发现,健康的个体有一个更广泛的微生物网络,并有较高数量的相关物种集中在周围。O.福米奇尼斯 这表明它们可能具有更大的微生物驱动草酸盐代谢的能力 108 .在形成结石的个体微生物组中,草酸盐降解所涉及的细菌基因水平也显著降低,这与24小时草酸盐的排泄量成反比。同样,草酸盐降解菌的累积丰度与尿草酸盐呈反比关系。103 .一项研究还报告了三个分类群中的氧化降解菌- 粪肠球菌 , 粪肠球菌 和 动物双歧杆菌 患肾结石的儿童比健康儿童少 105 .相比之下,早期的一项研究表明,高氧肝病和肾结石患者与健康对照者相比,有选择性地浓缩了氧化盐代谢菌种。104 .需要更多的平移和临床研究来建立草酸盐降解微生物群和尿草酸盐的丰度和功能之间的因果关系。
调节不良草酸盐内平衡
草酸盐生理内平衡的关键步骤中的功能障碍可导致不同类型的原发和继发高氧尿症(Figs. 1b和and2).2 )。高草酸血症的定义是尿草酸盐排泄量为40-45毫克/天(0.45-0.5毫摩尔/天),这与各种系统性表现有关。 34 , 109 .
原发性高血症
PH包括常染色体隐性遗传性酶缺乏,导致肝氧化发生增加(表2和Fig. 2 ;在参考文献中审查。110 )。对PH值的诊断主要基于临床表现,包括血浆和尿液中草酸浓度升高,并可通过遗传分析加以确认。 110 – 113 .最常见的PH表现包括尿路结石、肾钙中毒和尿路感染 111 , 112 , 114 .人口的传播频率估计为1:70,疾病流行率估计在1:58000到3:1000000之间(参考文献)。 113 )。PH1型(P1)的特点是丙氨酸-甘氨酸转氨酶缺乏。Agxt )。200多种 Agxt 突变已经确定,与一个高度可变的基因型-表型相关(见人类基因突变数据库) 110 .2022年的一项研究使用非规范性的剪接部位和拷贝号变异测序,以提高诊断准确率,从26%提高到35%的疑似PH值患者 115 .值得注意的是,另一项研究实施了生物信息学,以确定微米尔纳-4660,它抑制了变异性阴性氧化症患者亚群中的agt活动。116 .几种突变会导致agt的蛋白质聚集和线粒体聚集(在人类中,agt的功能需要适当的过氧性) 117 会导致酶活性下降或减弱 118 – 120 .2021年的一份报告表明,缺乏蛋白质二聚可能是ACTT有效性的基本机制之一。 121 .
Table 2 |原发性高血症类型、诊断和表现
2型PH(P2)约占PH值的7.9%-10%,其结果是 格拉普 编码乙二醇酸还原酶/羟基丙酮酸还原酶。在肝细胞的胞质和线粒体中,这种酶可以使乙氧基糖酸脱毒,使糖酸脱毒。111 , 112 .在GERHPR缺乏症中,乙氧基酸盐和羟基丙酮酸盐积累,随后转化为草酸盐, l -肝性LDHA甘油 112 .至少39个 格拉普 已经描述了突变 112 .PH_3型是由编码4-氢-2-氧化葡萄糖酸醛酶-1( 霍加1 ),主要在肝细胞线粒体中表达,占PH值的8.4%-17%。111 .霍加1通过将4-羟基-2-奥草戊酸酯(猪)转化为甘氨酸和丙酮酸,催化羟基丙氨酸代谢的最后一步;在缺乏霍加1的情况下,已报告猪的积累抑制了GERHPR,从而增加草酸盐的生产。19 .2021年的报告至少描述了37个 霍加1 突变 111 .据报告,疾病发病年龄在P3时期比P2时期更早(参考文献)。113 ),但有几项研究报告所有三种PH类型的中位发病年龄&10岁,范围延伸至成年后期 4 , 111 – 113 (表2).
丙氨酸-甘氨酸氨基转移酶;CDH,慢性肾病;GHRR,甘氨酸还原酶/氢化丙酮酸还原酶;霍加1,4-氢基-2-氧戊酸醛酶,1型;PER1,原发性高氧类1型。
PH的自然历史分为两个阶段,它们的精确时间表取决于潜在突变的严重性和类型。在第一阶段,草酸盐的合成量增加,由高氧阿卢症补偿,高氧阿卢症最高可达1-2毫摩尔/1.73米 2 并最终导致草酸在肾脏中沉积,并逐渐损害肾脏。第二阶段随着肾功能下降,草酸排泄不足,系统草酸沉积,导致二次器官损伤 4 .虽然尿草酸盐浓度与PH值的上升呈正相关,但最常见的P1-原因是 Agxt 突变,G170R,与其他P1驾驶相比,通常与不太严重的肾病进展相关 Agxt 突变。这种差异的部分原因可能是G170R基因型中通过使用辅助因子吡啶(又称维生素B6)(只有少数其他的P1引起的突变,如 Agxt F152I ,对吡啶的反应) 113 .值得注意的是,在迄今为止最大规模的P2研究中,在年龄修正分析中,CDH的进展与基因型或尿草酸分泌无关。112 .在这项研究中,P2患者在诊断时或15岁之前出现CDH第五期的可能性也比P1患者小。112 .在迄今为止最大规模的研究中,在P3、PER3基因型和表型之间没有相关性,而尿草酸盐的排泄量在维生素B6-非反应性P1、P2和FF3(Ref)之间没有显著差异。111 )。尽管据报道,由于P3引起的肾衰竭 113 大多数研究描述了与P1或P2患者相比,P3患者更温和的肾脏疾病。但是,由于缺乏长期成果监测数据,以及长期成果监测数据渗透率低,这些数据可能有偏颇 霍加1 突变 111 .
继发性高血症
次生高氧肝病广泛分类为肠道或膳食 29 .最常见的肠道高氧尿症的病因是胃分流术和胰腺功能不全。 122 ;其他包括吸收不良条件,如短肠综合征、腹腔疾病、克罗恩病和囊性纤维化,或使用干扰肠道草酸吸收的药物,如奥曲肽(一种生长抑制素类似物),或奥里司他(一种脂肪酶抑制剂)。 36 .饮食中的高氧肝病最常由过量摄入维生素C或草酸盐引起(上文已经讨论过) 122 .
所有类型的高草酸血症都有三种组织病理学特征:草酸钙晶体沉积、管状上皮损伤和肾间质改变。 29 .然而,这些模式在草酸肾病的不同病因之间可能有所不同。例如,在一项研究中,肠性高氧血症患者更有可能发生小管间质萎缩和纤维化,而非肠性高氧血症患者则有更明显的晶体管积累和间质炎症。 122 .作者推测肾的严重程度可能取决于草酸盐暴露后的潜伏期。然而,这些差异的机制在临床表现的肠和非肠高血症仍然未知。体内研究表明,晶体沉积对高氧肝素引起的炎症至关重要 123 .
慢性肾病
在PH值上,增加内源性合成草酸盐可导致疾病晚期血浆草酸盐浓度在80-125之间。 124 .在普通CDH患者中,由于肾损害,血浆或血清草酸盐含量升高,尤其是在接受透析的肾衰竭患者中。尽管如此,这些患者的血浆或血清草酸水平没有PH值患者高,除了克罗恩病和回肠切除的患者,维持性血液透析治疗的患者除外。124 – 126 .在这些患者中,血清草酸钙水平与血清样本中草酸钙过饱和相关,在某些情况下,可能会达到30倍的血清草酸钙过饱和阈值。124 , 125 (Fig. 1b )。虽然高血浆草酸盐与原发性高草血症患者肾功能下降有关 127 目前,关于草酸等离子体和较为常见的CDH结果的数据有限。尽管如此,尽管传统上被描述为肾结石和肾内晶体阻塞引起的急性肾损伤的危险因素,但在过去几年里草酸盐的作用进一步明确。用高草酸盐喂养的小鼠出现可重复CDH表型,其特征是高血压、高钾血症、代谢性酸中毒、贫血和高磷酸血症;肾脏组织病理学显示纤维化、管状损伤、肾小球和炎症。128 .流行病学研究还表明,尿和血浆草酸盐水平的升高可能与肾脏疾病的不良后果有关。一项对美国成年人常见CDH(慢性肾功能不全队列)的前瞻性研究表明,24小时尿草酸排泄物与CDH进展和肾衰竭之间有独立的联系。6 .尿草酸排泄物中最高五分之一的参与者,CDH进展的风险增加33%,肾衰竭的风险增加45%;24小时尿草酸排泄物也与蛋白尿水平增加和估计肾小球滤过率降低呈正相关。 6 .重要的是,由于透析不能完全补偿肾排泄的损失,透析时肾功能衰竭患者血浆草酸水平可以显著升高。在对德国接受透析的糖尿病患者的随机对照研究数据进行的一项特别分析中,草酸血四分之一水平最高与合并心血管事件风险增加40%有关(心脏病死亡、致命或非致命中风或非致命心肌梗死) 3 .在二次分析中,血草酸盐水平也与心脏猝死相关。
草酸盐作为生物标记物在肾移植患者中的作用也不清楚。尿草酸排泄与移植物存活无关 129 但异体活组织标本中草酸钙沉积物的存在可能与移植功能延迟和移植功能下降有关。 130 , 131 .在167个接受肾移植的患者中,15年来,他们在移植后10周测量血浆草酸盐,上四分之一的血浆水平与长期存活率较低和移植物损失有关;然而,在检查死亡检测的移植物损失时,这些相关性并不显著。 132 .
代谢疾病
几种代谢疾病与轻微的高氧血症有关。例如,肥胖症患者肾结石和高氧肝病的发病率较高,其相关因素包括:EGfr减少和CDH风险增加。133 .一个潜在的罪魁祸首是肥胖的致炎作用。肥胖小鼠尿草酸分泌量(按肌酐调整后)比瘦对照小鼠增加3.3倍,同时肠道草酸分泌量明显减少。这种分泌的变化可能是由于与瘦肉小鼠相比,肥胖小鼠的SLC26A6表达减少 134 .体外,促炎细胞因子抑制 Slc26a6 MRNA蛋白表达 134 .另一组研究人员发现,肥胖小鼠肝细胞中的糖醛酸途径改变导致肝细胞的高甲基化和降溶。 Agxt .这些改变导致羟基丙氨酸挑战后肝氧化发生显著增加 135 .此外,草酸排泄物与糖尿病的病理生理重叠也值得注意。糖尿病患者尿草酸排泄量比非糖尿病患者增加11% 6 ,其部分原因可能是草酸前体乙二醛和乙氧基酸浓度升高 27 .值得注意的是,糖尿病的存在与尿草酸盐排泄量为每天162毫克/天而尿草酸盐排泄量为每小时16毫克/天的风险降低50%或肾衰竭的风险增加了44%。 6 .
过多草酸盐的细胞效应
如前所述,草酸盐可以形成带正电荷矿物的复合物。这些复合物可以在尺寸上生长,形成草酸肾结石,阻碍泌尿流,造成肾脏损伤 133 .此外,草酸盐也能直接影响细胞功能。在体外,草酸能抑制肾脏上皮细胞的增殖,刺激纤维化转化和钙化,并诱导细胞死亡 128 , 136 .草酸盐也可能促进上皮-间充质转化 137 .用草酸盐培养小鼠髓内采集管细胞,增加间质标记物(如主动脉平滑肌肌动蛋白(又称主动脉平滑肌肌动蛋白)的表达,并减少E-卡塞林表达 138 .此外,草酸能激活肾上皮细胞中的烟酰胺腺苷二核苷酸磷酸酶,并激发活性氧的释放,从而促进氧化应激。139 与谷胱甘肽减少和线粒体功能受损有关 140 .
除了草酸盐对上皮细胞的影响,一些研究表明草酸晶体激活炎症细胞 141 .例如,草酸盐晶体刺激树突状细胞和巨噬细胞,通过激活纳希特、LR和PYD中含有的蛋白3(NLRP3)合成并释放IL-1型细胞。 5 , 9 .此外,人单核细胞暴露于低剂量草酸盐晶体会扰乱线粒体功能 142 .研究者推测这些生物事件可能会导致复发性结石形成。随后的研究表明,与对照细胞相比,草酸盐处理的巨噬细胞也降低了细胞生物动力学、线粒体复合体I和V的活性和三磷酸三磷酸三磷酸三磷酸酶水平。 143 .这些细胞的代谢、氧化还原平衡和细胞因子信号表达受到损害,从而降低了体外抗菌作用,增加了细菌感染的风险。143 .
2021年的一项研究表明,动脉粥样硬化患者和小鼠的血液中糖与草酸的比率均低于对照组。10.这一影响是由于抗逆转录病毒活性抑制,类似于在P1患者中观察到的。缺乏agt和脂蛋白E(APE)的小鼠与仅缺乏APP的小鼠相比,动脉粥样硬化增加了,后者伴随着诱导与炎症增加相关的肝原性途径(基于细胞因子和化学因子信号学的变化)。接触草酸盐的缺乏活性的小鼠巨噬细胞也表现出线粒体功能障碍和超氧化物积累,这导致原热性CC化学反应素配体5(CCL5)的释放增加。观察到的表型可以用AXT过度表达逆转。研究的局限之一是高浓度的草酸盐用于刺激巨噬细胞;尽管无细胞毒性,即使是那些肾排泄能力受损的患者,在血液中发现的750m的浓度仍然比在血液中发现的高好几倍。然而,这项研究表明了血浆草酸盐增多与动脉粥样硬化之间的机械联系。
这些观察结果支持了以前的研究表明草酸可能促进动脉粥样硬化。体外,细胞外草酸盐浓度对内皮细胞的增殖有抑制作用,并引起氧化应激。 8 , 144 .此外,来自单核细胞的草酸晶体诱导的促炎细胞因子IL-1a的释放与急性心肌梗死或CDH患者发生动脉粥样硬化性心血管事件的风险增加有关,可能是通过血管细胞粘附分子1在内皮细胞上的表达促进白细胞-内皮粘附和炎症 7.重要的是,未来的临床研究将需要解决在高草酸血症患者中观察到的草酸浓度是否能与体外接触到的草酸盐的超生理量产生相同的影响。
草酸盐失调治疗
对于轻微的高氧血症有许多保守的治疗选择,包括在肾结石患者中观察到的高氧血症。这些治疗方法以预防尿草酸钙结晶为基础,可能与充分的水化一样简单,这对于预防肾结石已被证明是有用的;建议对P1患者进行高水化治疗(>3l/1.73m)。 2 身体面积/日) 110 , 145 , 146 .此外,托尔沃坦的第一期试验表明,通过增加尿液容量,可以减少尿草酸钙、磷酸钙和尿酸过饱和。147 .硫氮嗪利尿剂也有类似的作用,其低钙和高磁尿的特性可能减少草酸钙肾结石的形成。148 .也有人建议用柠檬酸盐预防肾结石的形成 149 , 150 .另外,2016年的一项研究表明,柠檬酸盐和羟基柠檬酸能够在体外溶解草酸钙一水化物晶体。150 .即使在浓度比溶质低三倍的情况下,柠檬酸盐和羟基柠檬酸盐对草酸盐晶体表面的吸附也会导致钙离子和草酸盐离子的局部溶解,其效果相当 150 .值得注意的是,第二期临床试验的2022年报告表明柠檬汁可能是一种可行的药品配方的替代品。151 .
以草酸盐吸收为目标
在肠性高氧肝病,一些治疗方法是基于草酸盐在肠道结合,以防止过度吸收。如前所述,草酸盐的生物利用度受肠道健康和不同粪便成分(例如阳离子、脂肪或药物)的影响。14 , 36 , 37 .因此,直接补充钙和脂肪限制(据报道,增加肠道钙-草酸盐结合)可能减少草酸盐的高吸收。 146 , 152 .根据限制草酸盐吸收的相同原理,胆汁酸结合树脂胆红素通过阻断草酸盐与胆汁酸的结合和随后的肠道再吸收降低大鼠的结肠草酸吸收,但其对人体的疗效是不同的。153 .然而,在一个短肠综合征患者的案例研究中,霍乱可以减少粪便脂肪和尿草酸排泄物。 154 .含有钙的磷酸盐结合剂,可能促进钙-草酸盐复合物的形成,也被认为是潜在的降低草酸剂。155 .然而,目前的KDigo准则建议限制CDH阶段G3A-G5D患者使用钙基磷酸盐粘合剂,因为与非钙基磷酸盐粘合剂相比,与这些化合物相关的死亡风险增加 156 .在取得令人鼓舞的实验结果之后,非钙基磷酸盐粘合剂碳酸钡目前正在接受继发性高氧尿症和肾结石患者的第三阶段试验。157 .非磷酸钙粘合剂盐酸塞韦拉米尔治疗1周也导致尿草酸盐的无意义减少在一个开放标记的研究肠性高氧阿卢病患者 158 .值得注意的是,2021年的量子化学研究表明三价阳离子,如铁 3+ ,艾尔 3+ 或拉 3+ 而不是二价阳离子以及化学元素nd,可能是临床前试验中有趣的草酸结合剂。 159 .
微生物学相关疗法
在动物模型和一些人类研究中,微生物组操作对单一生物体或细菌群落草酸盐平衡的影响已被广泛评价(Fig. 4 )。因此,几种治疗配方主要是基于某些细菌的氧化降解能力。在啮齿动物模型中, O.福米奇尼斯 电离一直导致尿草酸盐减少 97 , 160 .除了草酸盐的降解, O.福米奇尼斯 产生了一种刺激分泌草酸的分泌物,但尚待确定。 97 .不过,尽管 O.福米奇尼斯 (冻干) O.福米奇尼斯 在肠涂膜胶囊中,后者具有较高的活细胞计数)被人类很好地接受,它们在第一-第三阶段试验中具有混合功效。 161 , 162 .
与…合并 双歧杆菌 和 乳酸菌 物种也减少了动物体内的尿草酸盐 97 , 163 .氧化物是一种益生菌,由 嗜酸乳杆菌 , 牛乳酸杆菌 , 嗜热链球菌 和 婴儿双歧杆菌 ,导致肠道高氧血症患者尿草酸盐短期减少 164 .重要的是,这些试验都没有评估消化后肠道的细菌活性。目前在早期试验中正在研究的其他细菌菌株包括诺-001、UblG-36和SINB8802。诺沃-001是一种治疗工程的微生物组合产品,包括NB1000(一种氧化还原菌)和NB2000P(一种用于控制NB1000(一种生物前控制分子)丰度的微生物组合产品。 165 .UblG-36,这是 加卡塞乳酸杆菌 应变,在体外降解草酸盐方面非常有效 166 .最后,口服合成草酸降解物SINB8802 E. coli 在小鼠和非人类灵长类动物中,对尿草酸盐有显著的降低作用。在基于人体肠胃生理学的硅化物模型中预测,该菌株可使肠性高氧肝病患者尿草酸降低71%。 167 .
整个微生物转移也被研究为调节草酸代谢的潜在途径。在大鼠体内,哺乳动物食草动物的粪便移植,其整个微生物群体适应于降解大量的膳食草酸盐,与吸收分解草酸的分离物相比,导致尿和粪便草酸水平下降。168 ;转移后,尿草酸盐持续下降9个月。 169 .同样地,常规老鼠的肠道微生物群类似人类的粪便移植,也减少了尿草酸盐。170.这种转移导致了肾和结肠中SLC26A6表达的减少,以及盲肠中表达的增加。迄今为止,还没有任何研究评估微生物群群体转移对人类的影响。
一些研究者已经尝试用草酸脱羧酶(OXDC)作为直接补充剂,而不是使用细菌菌株。O.福米奇尼斯 降解草酸盐。双盲随机对照交叉试验,在健康的个体中,一种专有的奥克斯达试验显示,与安慰剂相比,尿草酸降低了24%。171 .在第一期试验中,重组OXDC从 枯草芽孢杆菌 在胃旁路手术患者中,显著降低尿草酸盐(平均66.3毫克/天,基线标准差28.0毫克/天;44.5毫克/天,4周SD23.7毫克/天); P =0.018),但在特发性草酸钙结石形成患者中,这一减少不显著(43.2毫克/天,基线为SD5.9毫克/天;32.3毫克/天,4周为SD3.2毫克/天); P = 0.06) 172 .另一种OXDC制剂(ALL-177)显著减少了保留肾功能患者的尿草酸排泄量,包括对肠病和特发性高草酸病患者的第三阶段试验(所有参与者的尿草酸排泄量为77.7毫克/天,标准为55.9毫克/天;治疗4天后的尿草酸排泄量为63.7毫克/天,SD40.1毫克/天); P < 0.05) 173 .在CDH和严重肠内高氧血症患者的试点研究中,AL-177将血浆草酸盐比基线降低了29%。174 .然而,一项为期4周的肠性高草酸血症患者的第三阶段研究表明,尿草酸盐的减少仅比安慰剂的减少14.3%。175 .确定尿草酸盐的适度降低是否对结石的进展有临床益处将需要长期的随访研究。
原发性高氧血症的治疗
原发性高氧血症的治疗方案历来很少,唯一的治疗方案是肝和肾联合移植 110 .补充维生素B6可通过恢复APT活性和减少P1患者线粒体分泌,降低肝草酸盐的生成,这是由于P1患者的特异性。Agxt 在体内和临床上的突变,如G170R或F1522I 118 – 120 .更具体地说,体外研究表明,APT的单体形式不稳定,容易出现错误的折叠和聚集,这阻碍了过氧等位体的转移;维生素B6促进了双聚,这似乎稳定了酶,并可能促进适当的过氧等位体的转移。119 , 121 .
在维生素B6-非反应性P1中,治疗方法的目的是通过使用RNA干扰来抑制产生草酸盐(糖酸氧化酶,又称羟基氧化酶,和LDHA)的关键的肝酶。110 , 176 )。RNA干扰是大多数真核细胞的一种固有机制,它通过非编码的双链RNA片段(20-25BP长)来抑制基因表达的序列特异性。177 , 178 .这些小的干扰性RNA(SRNA)被RNA诱导的沉默复合物识别,从而导致目标mRNA的降解。177 , 178 .外来合成的SRNA已被誉为一个重大的治疗突破,它能够有效抑制致病基因。然而,研究人员仍在改进化学的sirna修饰,以优化特定器官的药物传递,并减少靶向以外的影响,包括意外免疫刺激 177 , 178 .
以锡尔纳为基地的卢马西兰是首个经EMA核准和fda核准的P1特定治疗,必须在皮下进行 110 .这种治疗使糖酸氧化酶基因沉默( HOO1 ),并在成人和儿童的第三阶段试验中,与安慰剂相比,被证明能减少641%-70%的草酸尿;第三阶段试验的第一个结果来自另一个第三阶段试验( NCT04152200 )现正接受品质管制 179 , 180 .血浆中糖酸盐浓度的增加似乎与不良事件无关。179 与之相反的是,在乙二醇中毒患者中观察到严重的酸中毒导致血浆糖酸盐浓度升高。181 .病例报告早在生命的第二周就显示了耐受性和有效性,并建议使用卢马西兰预治疗可以在PP1中使用孤立的肾移植(而不是肝移植)。182 , 183 )。尼多西兰,另一种经皮下注射的以锡尔纳为基础的药物,沉默 Ldha 经多次注射后可以减少68%的尿草酸分泌量 184 .该药物还成功地用于降低透析频率和延迟肝、肾联合移植的病人的P1(Ref)。184 );在第一阶段的研究中,在三分之一的P2患者中,Nedosian也使尿草酸排泄正常化。185).
基因编辑也被用来淘汰 HOO1 和 Ldha 在动物研究方面。CRISPR-CA9系统是由腺病毒载体提供的。 HOO1 在…中 AGxt1 −/− 老鼠,作为PP1模型;这种治疗标准化尿草酸盐排泄和预防无毒性肾钙中毒 186 .行政部门 Ldha -将腺病毒耦合的CRISPR-CA9系统锁定为具有P1-原因的大鼠 Agxt D205N 与对照组相比,突变降低了LDHA的表达50%,并显著降低了乙二醇激发后尿草酸盐的排泄量和肾草酸钙的沉积量。 187 .另一项研究 AGxt1 −/− 单剂量的腺病毒耦合CRISPR-CS9系统将LDHA表达降低95%,尿草酸降低到类似于乙二醇接触后的野生动物的水平,没有明显的毒性非靶点效应或肝毒性。 188 .在P3模型中( 霍加1 −/− 小鼠),相同的CRISPR-CAS9乳裂向量系统的有效性略低于P1模型,但也引起了LDHA表达的显著下降,尿草酸水平与羟基普林挑战后的野生动物相似。188 .值得注意的是,在法尔3模型中,没有一个小鼠在暴露于羟丙氨酸后发生肾损伤(与P1小鼠受到乙二醇的挑战相比) 188 .需要进行更多的研究,以测试这些结果的适用性以及对人类的潜在非目标影响。
免疫调制
免疫调节是治疗与草素相关疾病的另一种潜在方法。例如,抑制nlrp3炎症团激活可以通过卡氏酶1减少促炎细胞因子IL-1卵和IL-18的分裂,并抑制炎症细胞死亡(焦化) 189 .微云母-22-3P结合NLRP3和长中间基因的非蛋白编码RNA339,这是在人肾近端上皮细胞中用一水草酸钙处理的高水平。体外培养可降低人肾近端上皮细胞中氧化钙引起的炎症体激活和脓性下垂。 190 .在对雄性高氧大鼠的研究中,抑制在NLRP3上游发挥功能的瞬态受体电位香草素1通道,减轻了活性氧物种引起的NLRP3激活和氧化钙引起的肾病,但没有减少高氧氢尿症。191 .其他NLRP3抑制剂具有很有前途的小鼠体内研究结果包括以二甲基磺胺为基础的PC-456772,它能减缓晶体诱导的肾纤维化。192
结论
大量证据支持了过量草酸盐在破坏草酸盐摄入、生产和排泄之间平衡时的病理作用。总体而言,50%-80%的草酸是由内源性的氨基酸和碳水化合物代谢产生的,而20%-50%的草酸则来自饮食摄入,主要吸收在小肠中。草酸盐经阴离子交换的上皮运输介导草酸盐沿胃肠道、肝脏和肾脏的吸收和分泌,SLC26A6是建立最好的草酸转运蛋白。人体肠道含有重要的微生物网络,帮助调节草酸盐水平,最值得注意的是专家草酸降解菌 O.福米奇尼斯.遗传性酶缺陷导致内源性草酸生成增加或肠道吸收草酸增加在继发性高草血症可导致草酸肾病和肾衰竭。此外,尿草酸浓度升高与CDH进展有关,血浆草酸水平上升与需要透析的肾衰竭患者心血管死亡率有关。此外,在高草酸排泄的背景下,如肥胖和糖尿病等代谢性疾病的存在,可能会增加发生肾结石和高草酸血症或失去肾功能的风险。在细胞水平,草酸抑制增殖,刺激纤维化转化和钙化,通过促进炎症体活化和氧化应激,导致致炎和炎症途径的上升,并诱导细胞死亡。
草酸盐失调的治疗旨在重建维持草酸盐平衡所需的生理成分(表3)。尿和肠道中游离草酸的调节已被用来作为缓解肾结石和继发性高草酸血症的一个成功的策略。一个有希望的方法是异基因转移的氧化降解微生物群落减少尿草酸盐。相比之下,PH的治疗侧重于恢复参与肝氧化生成的酶的功能,例如,通过补充维生素B6来选择PH的亚型,或通过SRNAS或CRISPR-CA9技术来抑制生成草酸的LDHA或糖酸盐氧化酶。最后,免疫调节是预防和治疗与草糖相关疾病的严重后果的另一种潜在方法。
Table 3 |针对草酸盐失调的新治疗方案
A 临床试验。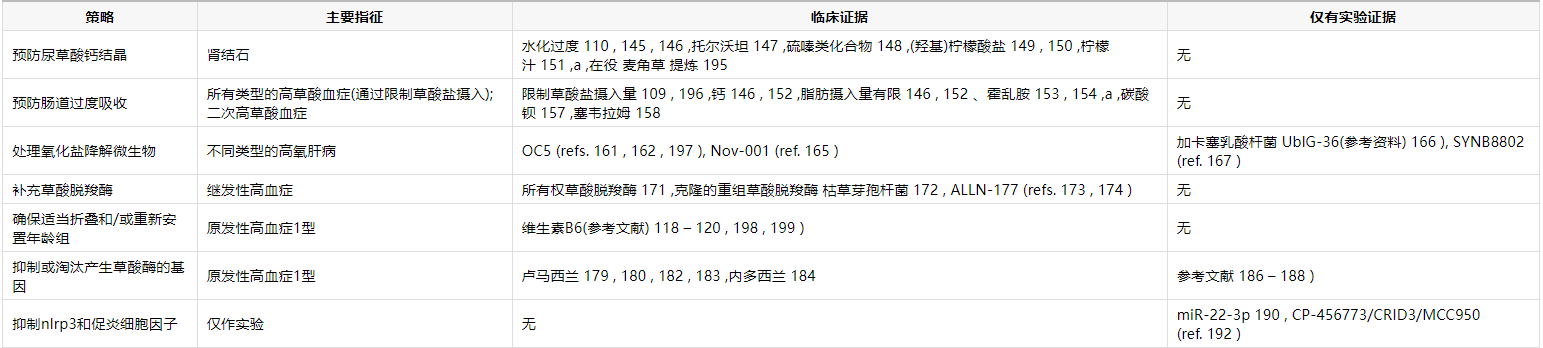
丙氨酸-甘氨酸氨基转移酶;NAN,不适用;NLRP3,NACT,LR和PYD中含有的蛋白3。
需要进一步研究,以更好地描述来自SLC26阴离子交换器家族和微生物群体的不同运输蛋白在维持草酸的平衡中的作用和治疗潜力。重要的公开问题包括草酸盐在多大程度上与CDH和CKD相关的心血管疾病的进展有关,以及实现持续降低草酸盐浓度的有效治疗战略。此外,对草酸产生有害影响的炎症途径进行更详细的研究,可能会发现新的治疗方法。强有力的临床研究是体外翻译的下一个必要步骤,在人体内和观察性的临床发现进入人体环境,并利用这一知识在临床实践中预防和治疗与草酸有关的疾病。
要点

不感兴趣
看过了
取消

人点赞

人收藏

打赏
不感兴趣
看过了
取消

打赏金额
认可我就打赏我~
1元 5元 10元 20元 50元 其它
打赏作者
认可我就打赏我~
扫描二维码
立即打赏给Ta吧!
温馨提示:仅支持微信支付!
已收到您的咨询诉求 我们会尽快联系您
