临床癌症的工程化T细胞疗法——TCR-T
预计,由于工程T细胞、基因编辑和细胞制造方面的技术进步,未来基于T细胞的疗法的基础将扩展到其他细胞类型,如诱导多能干细胞、造血干细胞和NK细胞。
工程化T细胞疗法
早期过继性免疫治疗主要是将自体口服的肿瘤反应性T细胞输回患者体内,以攻击患者的肿瘤,这个方法已经成功。但该疗法并未得到广泛应用,主要是由于侵袭性淋巴细胞数量少,且不能提高机体自身免疫系统的抗肿瘤能力。T细胞基因工程疗法可以在一定程度上克服T细胞存活率低、迁移率低和免疫逃逸等挑战。从患者的血液中提取T细胞并进行基因改造以编码识别癌症特异性抗原的受体(图1)。其他基因,例如那些编码细胞因子的基因,也可以被修改以延长存活时间并促进T细胞渗透到癌症组织中。CAR-T细胞疗法和T细胞受体(TCR)-T细胞疗法作为最新、最有效的免疫治疗技术,近年来得到广泛研究。本文主要介绍TCR-T细胞疗法目前在全球临床试验中的应用。关于使用基因工程T细胞疗法的临床研究已显示出显着的成功。预计基因工程T细胞免疫疗法将成为安全、耐受良好、有效的疗法,为癌症患者带来希望。
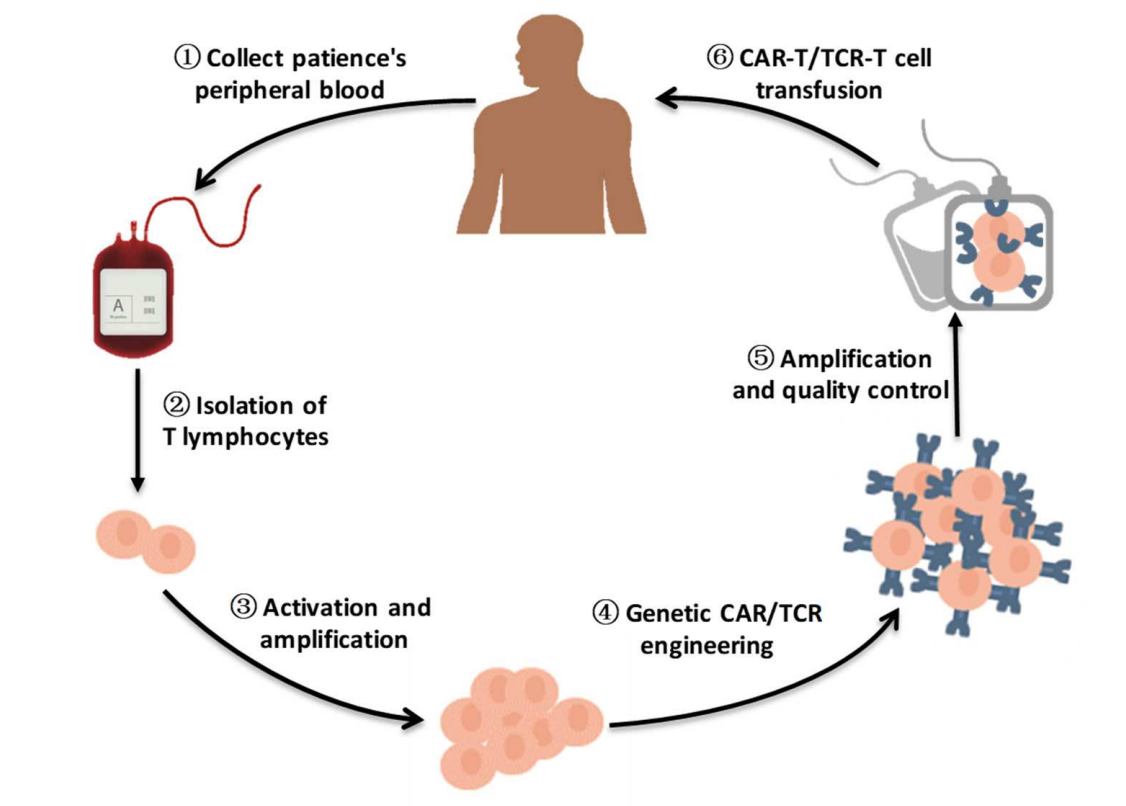
图1. 工程化T细胞疗法的简要流程图。
从患者身上抽取足够量的血液以获得足够的外周血单核细胞(PBMC)用于工程化T细胞制造。T细胞是从患者的PBMC中纯化的。在体外激活和扩增后,T细胞通过病毒载体转染,如慢病毒转染或逆转录病毒转染,在T细胞表面表达特异性CARs/TCRs。经过扩增和质量控制,CAR-T细胞/TCR-T细胞被注入患者体内,以提高抗肿瘤能力。
TCR-T细胞疗法
TCR和CAR疗法都是在体外修饰患者自身的T淋巴细胞,然后将它们注射回患者体内以杀死癌症,但它们识别抗原的机制却大不相同。TCR使用由α和β肽链组成的异二聚体来识别MHC分子呈递的多肽片段(图2)。另一方面,CAR-T细胞使用与癌细胞表面特定抗原结合的抗体片段。CAR-T细胞疗法识别的靶抗原都是细胞表面蛋白,而TCR-T细胞疗法可以识别MHC分子呈递的细胞内抗原片段,因此TCR-T细胞疗法的靶点范围更广。然而,TCR-T细胞疗法受MHC限制,依赖MHC分子的呈递来识别靶标并激活T细胞功能,因此这些特性也是TCR-T细胞疗法的一个劣势。
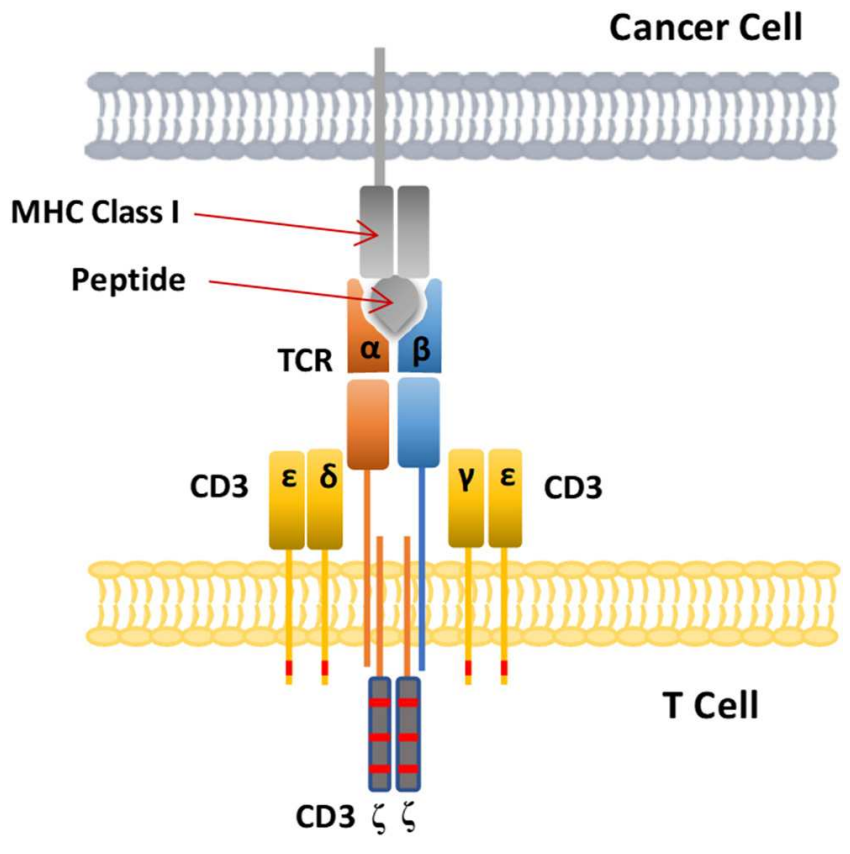
图2. TCR复合物是一种异源二聚体,由两条不同的肽链TCRα和TCRβ组成,并被4个CD3链包围。MHC I类分子呈递癌细胞的细胞内抗原肽,用于识别T细胞受体。
Michael Steinmetz博士首先将TCR基因从一个T细胞转移到另一个T细胞,使第二个T细胞具有相同的抗原特异性。这个过程是当前TCR基因治疗的起源。TCR是T细胞表面的特异性受体和特征标记。TCR-T细胞是经过基因改造的TCR产品,可以识别特定抗原。TCR-T细胞技术背后的核心目标是直接修改TCR与肿瘤抗原的结合。人类TCR对这些抗原的亲和力相对较低,无法有效识别和杀伤肿瘤。人工设计的高亲和力TCR通过基因工程技术在T细胞中编码,在T细胞识别肿瘤细胞过程中增强了特异性识别和亲和力。
高亲和力TCR-T细胞的构建需要识别特定的靶点。首先鉴定癌细胞呈递的多肽,然后筛选出正常组织呈递的多肽。确定靶点后,建立TCR噬菌体展示库,筛选具有高亲和力和特异性的TCR。然后进行临床前安全性测试以确保最小的脱靶效应和交叉反应性。
在一份报告中,在修改了几个关键氨基酸后,所得TCR对常见癌抗原[肿瘤相关抗原(TAA)]、纽约食管鳞状细胞癌(NY-ESO-1)的亲和力大大增加,这TCR可用于攻击过表达NY-ESO-1的癌症,例如多发性骨髓瘤。在这项临床试验中,80%的多发性骨髓瘤患者有良好的临床反应,其中70%的患者有完全或接近完全的反应。
TCR-T细胞疗法的优势与挑战
任何能被MHC分子呈递的抗原,都可以被TCR-T细胞识别,无论是细胞内或细胞表面抗原,还是肿瘤细胞突变后产生的新抗原。TCRs可以识别癌细胞的内部分子,TCR-T细胞通过基因工程可以大大提高对癌细胞的亲和力。因为它们保留了TCR信号转导通路的所有辅助分子,当存在少量抗原时,TCR-T细胞就可以被充分激活,产生杀伤作用。
TCR-T细胞技术发展的难点包括良好靶点的选择、特异性TCRs的寻找、最佳TCR亲和力的筛选、安全性评估、时间和成本。靶点选择是最重要的方面之一。这些问题已经成为TCR-T细胞治疗的障碍,寻找解决这些问题的方法成为决定TCR-T细胞成功与否的关键。
大多数TCR-T细胞治疗靶点受到MHC类别的限制。此外,外源链和内源链之间存在杂交(错配)的风险,这可能会导致对自身抗原的有害识别,导致移植物抗宿主病。TCR亲和力增加会带来错误靶向的风险,因此应谨慎应用TCR-T细胞疗法。TCR-T细胞疗法已显示出一定的治疗潜力,但仍存在许多局限性,例如组织相容性抗原的匹配以及需要在细胞表面呈递抗原等。
TCR-T细胞疗法在血液恶性肿瘤中的临床靶点
白血病干细胞的特异性靶向免疫治疗是治疗恶性骨髓肿瘤的理想方法(表1),但相应的表位尚不清楚。来自健康干细胞供体和急性髓系白血病患者的造血干细胞和祖细胞的比较蛋白质组学特征可能揭示了可用作表面标志物或作为受影响分子途径的替代品的差异表达蛋白质。
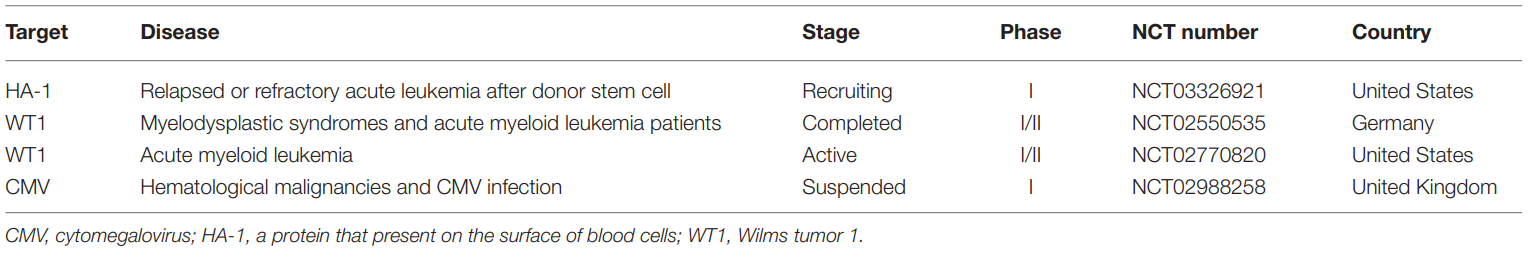
表1. 目前TCR-T治疗血液系统恶性肿瘤的临床靶点
TCR-T细胞治疗实体瘤的临床靶点
由TCRs激活的T细胞可以靶向大多数肿瘤特异性抗原,特别是那些细胞内的抗原。因此,许多TCR-T细胞技术已应用于实体瘤的临床试验(表2和图3)。由于其相对孤立的生理位置和独特的免疫抑制微环境,免疫疗法对实体瘤的效果不如对血液肿瘤有效。为了克服实体瘤的分离生理位置,在小鼠模型中使用了将T细胞局部注射到肿瘤中。局部注射的效果优于全身给药所达到的效果,例如在脑肿瘤中将T细胞注射到脑脊液中。
表2. 目前TCR-T治疗实体瘤的临床靶点
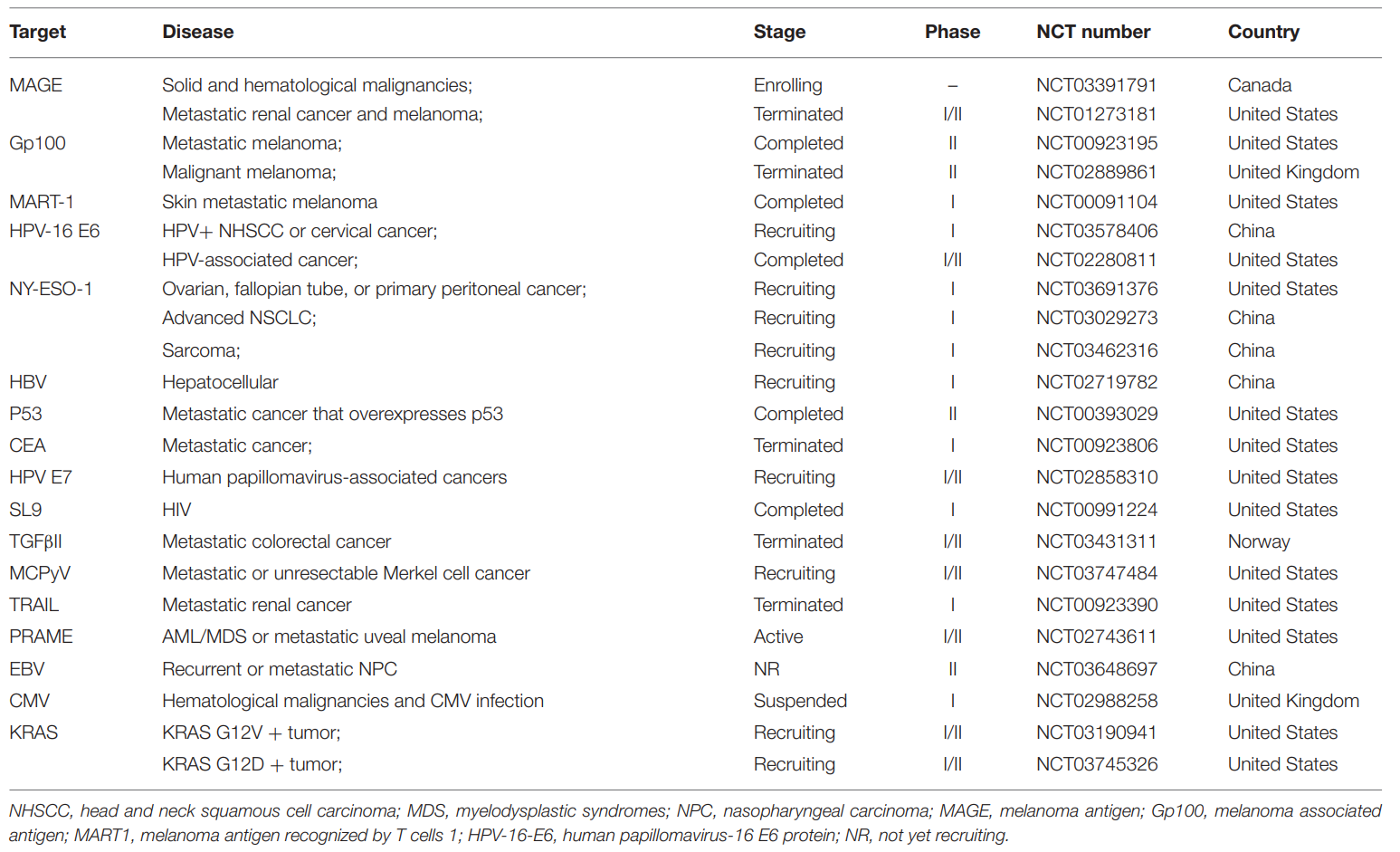
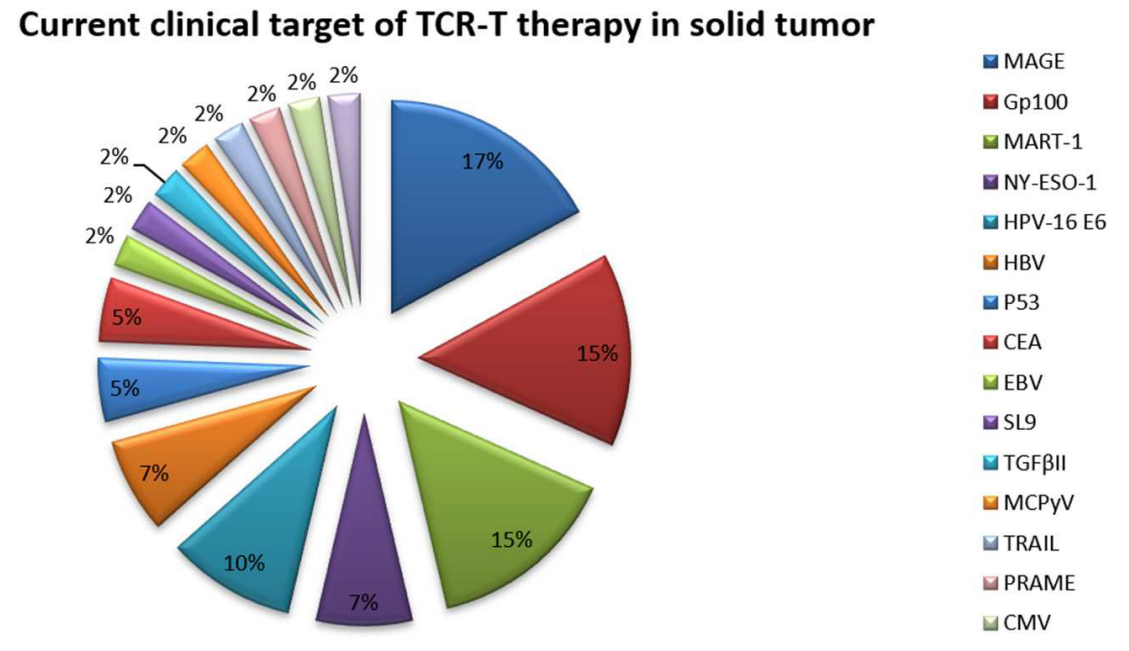
图3. 目前TCR-T治疗实体瘤的临床靶点。饼图基于ClinicalTrials.gov上注册的实体瘤TCR-T临床试验的统计结果。
已发表的血液恶性肿瘤临床TCR-T细胞疗法
基因修饰的T细胞疗法的临床应用使抗CD19 CAR-T细胞治疗的白血病和淋巴瘤患者的反应率达到了前所未有的水平。虽然CAR-T细胞疗法在CD19+血液肿瘤如淋巴瘤和白血病中显示出显着的疗效,但CRS和神经毒性等危及生命的副作用限制了CAR-T细胞疗法的临床应用。Eureka Therapeuticshas在其专有的抗体-TCR(AbTCR)平台上发布了临床前数据,证明AbTCR-T细胞在小鼠模型中具有与现有抗CD19 CAR-T细胞相同的抗癌作用;然而,AbTCR-T细胞中炎性胞质分裂的产生显着减少,降低了CRS的风险。更安全的T细胞疗法可以为患者提供更大的治疗窗口,同时降低患者和整个医疗保健系统的直接和间接成本(表3)。
表3. 已发表的血液系统恶性肿瘤临床 TCR-T 治疗

已发表的实体瘤临床TCR-T细胞疗法
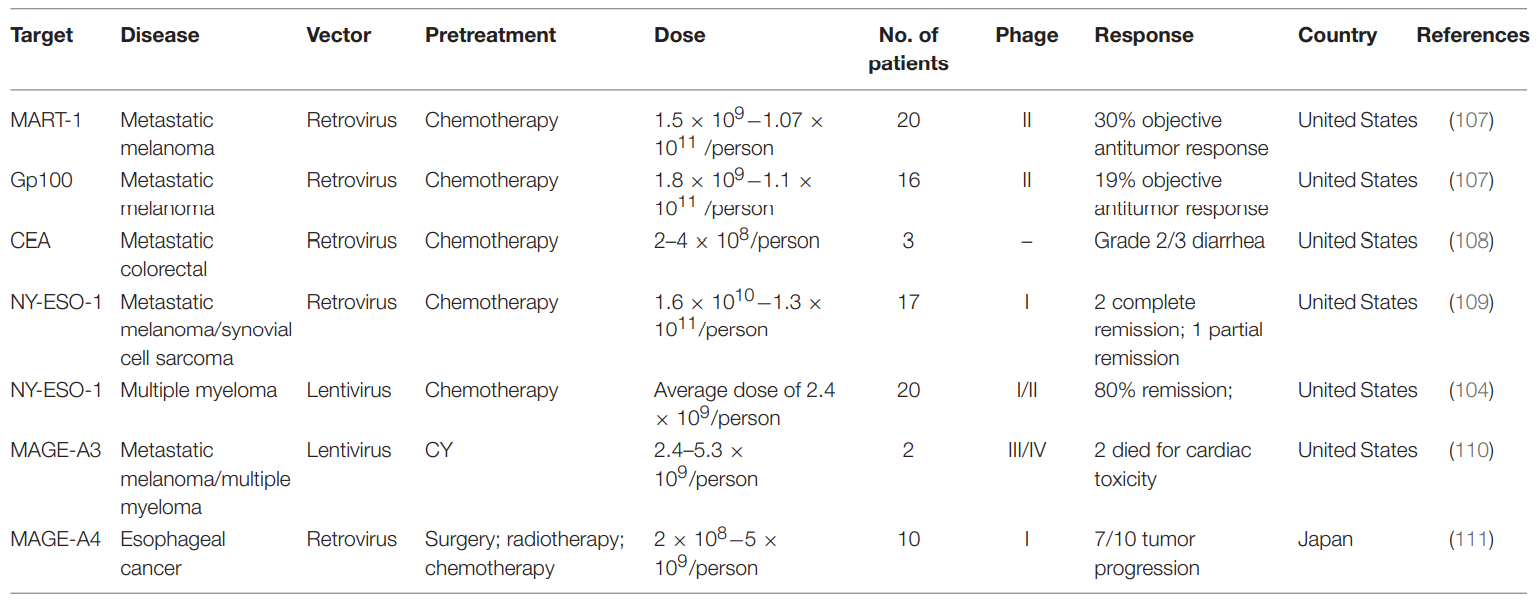
研究人员分离出内源性TCR,对其进行改造,并将这些经过改造的T细胞引入人体。这样,具有靶向癌细胞能力的T细胞数量就会增加,这有望帮助识别和靶向多种实体瘤和血液肿瘤(表4)。
表4. 已发表的实体瘤临床TCR-T治疗
CAR-T细胞和TCR-T细胞疗法之间的差异
CARs不仅可以识别肽抗原,还可以识别碳水化合物和糖脂抗原,这扩大了可靶向的癌症抗原库。CAR-T细胞疗法不受MHC类别限制。CAR-T细胞可以靶向癌细胞的非蛋白糖脂抗原,多维度识别抗原。CAR-T细胞治疗实体肿瘤和血液肿瘤的问题在于靶抗原都是细胞表面蛋白。即使CAR-T细胞对肿瘤细胞有强大的杀伤作用,但如果没有合适的、特异性的细胞表面靶蛋白,CAR-T细胞疗法也无法产生真正的影响。由于MHC分子可以呈递从细胞表面或细胞内蛋白质获得的肽链,因此TCR可以比CAR靶向更多的抗原。这些抗原,包括CEA、HER-2、CD19、gp100、MART-1、MAGA-A3和NY-ESO1,适用于TCR-T细胞疗法。TCR靶向具有肿瘤特异性的细胞内蛋白质。这些抗原包括由肿瘤DNA随机突变产生的新抗原和所谓的癌症睾丸抗原。这些抗原通常仅在部分肿瘤和生殖器组织中表达,而MHC分子在生殖器组织中不表达。TILs和TCRs只能识别由特定MHC分子呈递的抗原,并且可能由于肿瘤细胞中MHC分子的下调或突变而逃避免疫监视,从而导致临床局限性。基于TCR的疗法可能优于基于CAR的疗法,因为TCR-T细胞使用天然T细胞信号传导机制。
CAR-T细胞疗法的剂量比TILs和TCR-T细胞所需的剂量低两到三个数量级。由于CAR-T细胞疗法靶点明确,识别肿瘤表面抗原特异性高,能够克服MHC限制,因此CAR-T细胞疗法所需的单次输血细胞数远小于TCR-T细胞疗法或TIL疗法所需的细胞数,以产生相同的治疗效果。
总结
免疫疗法与传统疗法不同,它通过招募自身免疫系统并用它来攻击肿瘤来直接作用于癌细胞。抗肿瘤免疫反应可不断识别和记忆肿瘤抗原,并随时间不断扩大;可重复此循环以加强抗肿瘤免疫反应。随着免疫反应的扩大,一些细胞毒性T细胞分化为成熟的记忆T细胞,即使在原发抗原刺激不存在的情况下也能提供长期的免疫记忆。因此,免疫疗法可以为患者带来持久的益处和长期的生存。
一种新药或新疗法的开发并不容易,而且往往耗资数十亿美元。Juno Therapeutics致力于肿瘤细胞免疫的研究,是该领域的先驱之一。目前针对CD19的CAR-T细胞产品研究比较广泛,两款获批的产品均针对CD19治疗血液肿瘤。在全球范围内,CAR-T细胞的研发管线快速扩张,包括探索新靶点,如BCMA、CD123、CD33,以及向新适应症的扩展,如血液肿瘤进展为实体瘤。全球已有多家公司将项目推向临床阶段,预计未来会有针对不同肿瘤的CART细胞产品。随着临床试验新结构的推广和生产技术的改进,第三代和第四代CAR-T细胞产品有望获得更好的疗效。针对实体瘤靶点如WT-1、L1CAM、ROR-1、MUC-16、LewisY、HPV-16等的TCR-T疗法也正在进行临床试验。对于实体瘤,TCR-T疗法可能更有利。Kite Pharma、Juno Therapeutics、Adaptimmune Therapeutics等全球多家公司都在致力于TCR-T免疫疗法的研发,希望带来切实可行的治疗方案。
工程化T细胞的制备仍依赖于传统的人工操作,细胞质量和稳定性难以保证。而且,疗效大大降低。随着工程化T细胞技术的不断进步,可以预见,工程化T细胞的自动化生产将是未来的一大趋势。我们也期待工程化T细胞疗法在技术上变得更加成熟、安全和高效。肿瘤免疫治疗很快就会给很多癌症患者带来希望。开发细胞疗法的一些最大挑战包括缺乏临床前模型来评估这些复杂疗法的安全性和有效性,以及对早期临床研究中发现的安全问题的反应。此外,实体瘤的治疗还存在诸多障碍。
预计,由于工程T细胞、基因编辑和细胞制造方面的技术进步,未来基于T细胞的疗法的基础将扩展到其他细胞类型,如诱导多能干细胞、造血干细胞和NK细胞。这些适应症也将超越癌症,预计将包括传染病、器官移植和自身免疫性疾病。
参考文献:
Zhao, L., & Cao, Y. J. Engineered T Cell Therapy for Cancer in the Clinic. Frontiers in Immunology, 10, 2250.
不感兴趣
看过了
取消

人点赞

人收藏

打赏
不感兴趣
看过了
取消


















 010-82736610
010-82736610
 股票代码: 872612
股票代码: 872612
 京公网安备 11010802020745号
京公网安备 11010802020745号










