机器学习提高肿瘤免疫治疗预测效果
是否有可靠的生物标志物组合能预测对免疫检查点阻断的反应?准确预测对帮助患者分层及预估患者是否对免疫阻断单独疗法有应答,是否需要组合疗法或接受其他的治疗十分必要。
免疫检查点抑制剂在临床上的成功,使癌症的免疫治疗焕发了新生命。免疫检查点药物分为两大类,一类是以PD1为代表的抑制剂,一类是激活剂,激活剂目前处于临床研究阶段。靶向CTLA-4或PD-1/PD-L1的免疫检查点阻断药物,对晚期癌症患者可产生持久的显著治疗效果。然而,只有少部分癌症患者对免疫检查点抑制剂治疗有响应,是否有可靠的生物标志物(biomarker)组合能够预测对免疫检查点阻断的反应?准确的预测对于帮助患者分层以及预估患者是否对免疫阻断单独疗法有应答,是否需要组合疗法或者接受其他的治疗是必要的。一些大型3期临床试验,因未对入组的患者进行精准筛选,导致试验失败,进一步强调了精准筛选免疫抑制剂潜在获益人群的必要性。
纪念斯隆凯特琳癌症中心(MSKCC)Timothy A. Chan教授团队在Nature Biotechnology上发表了一篇名为Improved prediction of immune checkpoint blockade efficacy across multiple cancer types的文章,研究基于机器学习,整合基因组、分子、人口统计学和临床检测数据,用于预测对免疫抑制剂的反应。该研究共纳入了1479名患者,属于16种不同的癌症类型,均接受了免疫治疗。通过回顾性分析,该模型在预测免疫治疗的临床反应方面具有高度的敏感性和特异性,在不同癌症类型的测试数据中,可对患者总生存期(OS)和无进展生存期(DFS)进行预测。该模型显著优于FDA已批准的基于肿瘤突变负荷(TMB)的预测方法。研究者预计,该方法将显著改善免疫治疗的临床决策,并为未来的精准干预提供指导。
RF16机器学习模型
为了计算免疫治疗应答的概率,研究者们开发了一个包括16个输入特征的集成学习-随机森林分类器(简称RF16)。输入的信息如下:
-肿瘤突变负荷(TMB)
-拷贝数改变(FCNA)
-HLA-I进化分化(HED)
-杂合性损失(LOH)
-HLA-I状态
-微卫星不稳定状态(MSI)
-体质指数(BMI)
-性别
-中性粒细胞-淋巴细胞比值(NLR)
-肿瘤分期
-免疫治疗药物
-年龄
-癌症类型
-免疫治疗前是否接受化疗
-白蛋白、血小板、血红蛋白(HGB)水平
按癌症类型,数据集随机分为训练集(80%,n=1184)和测试集(20%,n=295),通过开发的预测算法,对训练分类器进行评估。研究者们对测试的训练集数据进行了五倍交叉验证,获得基于二元分类(有应答和无应答)的免疫治疗反应预测模型。
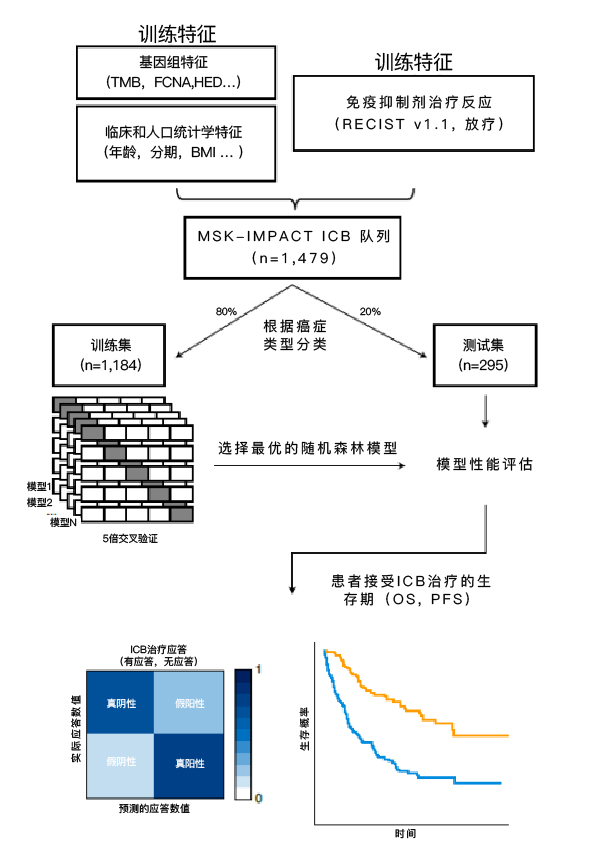
▲机器学习模型构建过程
模型纳入的数据来自纪念斯隆凯特琳癌症中心(MSKCC),包括16种不同癌症类型,共1479例患者的完整临床、肿瘤和测序数据。
-约37%的患者属于非小细胞肺癌(NSCLC)。
-13%的患者属于黑色素瘤。
-50%的患者属于其他癌症类型(以下简称“其他癌症”),包括肾细胞癌、膀胱癌、头颈部肿瘤和结直肠癌。
这些患者接受了PD-1/PD-L1抑制剂、CTLA-4阻断剂或两种免疫治疗药物的联合治疗。经过分析:
-409例癌症患者对免疫治疗有应答。
-1070例不同癌症患者对免疫治疗没有应答。
通过机器学习模型,研究者们可以量化生物特征,有助于解释患者间免疫抑制剂治疗应答的差异。个体水平上,研究者可根据每个患者的应答概率对其进行评分(分值越高,代表对免疫抑制剂治疗应答的概率越高)。
- 肿瘤突变负荷(TMB)是占权重最大的预测因子,这一结果与多个独立研究的数据一致。
-化疗史对ICB反应的影响与TMB相似。
-值得注意的是,该模型并没有将MSI状态作为权重较高的预测因子,可能是因为它与TMB有很强的相关性。
-研究者们量化了白蛋白、HGB和血小板水平对治疗应答的相对影响。众所周知,血液中的生物标志物可反映肿瘤促进炎症程度,作为肿瘤微环境的重要组成,具有促进血管生成、转移和免疫抑制的功能。
-但有趣的是,放疗与免疫治疗结合,有一定的“增敏”作用。
机器学习模型性能
研究者试图从多个维度系统评估临床-基因组学模型的性能。为系统评估癌症类型、患者在免疫治疗前是否接受化疗和血液标志物(白蛋白、HGB和血小板)与其他影响免疫治疗反应的变量的预测能力,研究者们开发了第二个随机森林模型(以下简称RF11),此模型仅包括变量FCNA、TMB、HED、NLR、NLR、BMI、LOH、性别、年龄、MSI状态、肿瘤分期和药物类别。RF11用于确定没有被广泛用于预测免疫治疗响应的特征变量的价值。由于TMB已被FDA批准作为预测ICB在实体肿瘤中的有效的生物标志物,研究者还将集成的RF16和RF11模型与单独基于TMB的预测进行了比较。
为评估RF16、RF11、 TMB的预测性能,研究者们计算了各模型的ROC和AUC。与TMB和RF11模型相比,RF16模型在预测有应答者和无应答者方面具有更优的性能:训练集-(泛癌种AUC:RF16为0.85,RF11为0.79,TMB为0.62),测试集-(泛癌种AUC:RF16为0.79,RF11为0.71,TMB为0.63)。研究者还证实,无论在训练集和测试集中,RF16模型的AUC都高于TMB和RF11。
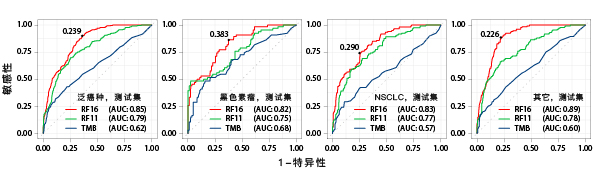
▲各模型性能对比
RF16的任何特征因子的性能都不能达到RF16的性能水平,表明多个特征的非线性组合对系统预测性能有不同程度的影响。在不同癌症类型中,有应答者和无应答者之间的应答概率有差异。
为对比RF16和TMB单独预测有应答者和无应答者的性能,研究者们使用≥10mut/Mb作为TMB的临界值,该指标已被FDA批准用于指导帕博利珠单抗免疫治疗。研究者们发现,对比敏感性、特异性、准确性、阳性预测值(PPV)和阴性预测值(NPV),与单独TMB相比,RF16模型自始至终都具有更高的预测性能。
综上所述,RF16机器学习模型可高度精准地预测患者对ICB治疗的应答。
机器学习模型预测多种癌症患者的OS和PFS
为了测试研究者开发的机器学习模型是否可预测免疫治疗前的总生存期(OS),研究者们使用Brier评分,通过计算观察到的OS和预测的OS之间的误差,量化预测的准确性。对比发现,RF16的预测结果比单独的TMB模型、RF11的预测误差更小。此外,研究者们发现,与对照组中被归类为无反应的患者相比,RF16模型预测得到的免疫治疗反应者与更长的OS显著相关。
RF16对无进展生存期(PFS)的精准预测明显高于单独使用TMB。不同癌症类型中,RF16预测的有应答者和无应答者之间的PFS差异大于单独的TMB。
总之,数据表明,该机器学习方法可在免疫治疗前精准地预测癌症患者ICB反应、OS和PFS。此外,该研究结果表明,精准预测ICB应答需要一个系统模型,模型中包括遗传信息(胚系和体细胞变异)、临床和人口统计学特征因子,以及反映患者整体健康状况的血液指标。
但是,该模型的一个局限是,研究者们没有用到转录组数据、肿瘤PD-L1免疫组化数据,而这些是评估肿瘤免疫微环境的重要信息。另一个局限是,用于构建模型的患者群体规模有限,并不一定能代表全球的目标人群,因此还需要基于临床试验,对大人群患者队列进一步验证,以便获得更精准的模型性能。
研究者们预计,随着肿瘤分子生物学数据的可及性,未来的前瞻性临床试验,有望通过机器学习实现患者精准分层。具体来说,肿瘤免疫微环境的分子特征;微生物组信息;T细胞受体多样性;肿瘤特定基因组改变,如DNA损伤应答和修复相关基因的突变、与ICB耐药性相关突变;转录组数据的加入,有助于进一步提高预测性能。研究者认为,未来定量的机器学习模型将在肿瘤精准免疫领域,对改善患者预后具有重要的意义。
参考资料
Chowell, D., Yoo, SK., Valero, C. et al. Improved prediction of immune checkpoint blockade efficacy across multiple cancer types. Nat Biotechnol 40, 499–506 (2022). https://doi.org/10.1038/s41587-021-01070-8.
不感兴趣
看过了
取消

人点赞

人收藏

打赏
不感兴趣
看过了
取消


















 010-82736610
010-82736610
 股票代码: 872612
股票代码: 872612
 京公网安备 11010802020745号
京公网安备 11010802020745号










