又见BCMA ADC药物临床失败,BCMA靶点差异化
总体来看,新药研发无疑具备研发投入高、失败率高、风险大的显著特点,但即使成功率不高,无论是开发更多新型药物还是拓展新适应症,靶点的差异化探索之路仍会继续。
作者:粽哥2025
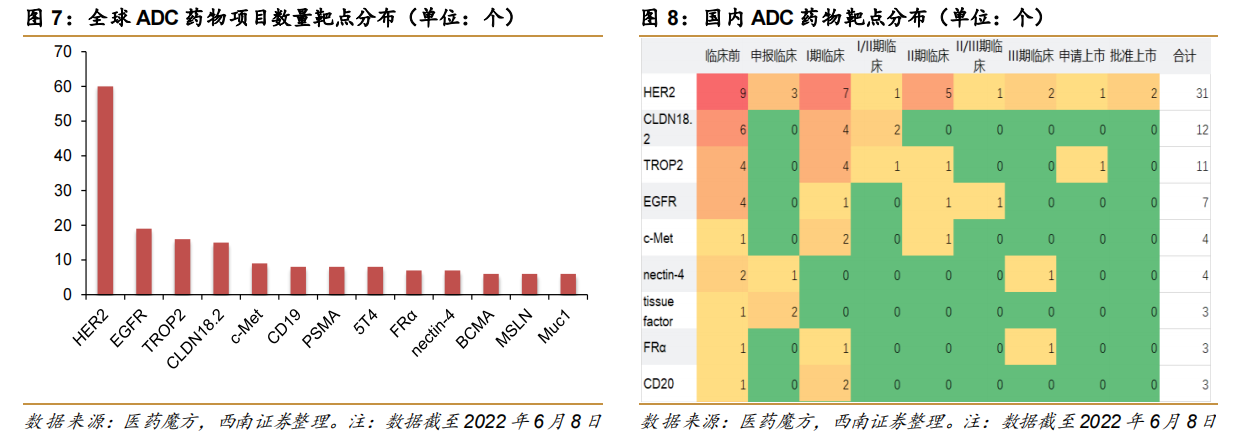
众所周知,目前全球ADC药物的研发主要集中在最为热门的HER2靶点上,呈现出同质化严重的态势。其次,EGFR、CD19、c-Met等相对成熟的靶点也有较多在研药物。
反过来,聚焦于CAR-T疗法和双抗药物的BCMA靶点,在研BCMA ADC药物较少,且主要以海外药企布局为主。
不过,尽管BCMA ADC药物具备一定的差异化优势,但临床失败案例也不少见。
11月7日,葛兰素史克(GSK)宣布其研发的BCMA ADC药物Blenrep在治疗多发性骨髓瘤的III期临床研究中未能达到无进展生存期(PFS)主要终点而失败。
该III期临床(DREAMM-3)旨在比较Blenrep(belantamab mafodotin)单药 vs. pomalidomide(泊马度胺)联合低剂量地塞米松(PomDex)治疗复发或难治性多发性骨髓瘤(RRMM)的疗效。
实际上,这不是BCMA ADC药物第一次遭遇临床失败。
2021年4月,阿斯利康(AZ)就宣布停止了BCMA ADC药物MEDI2228在多发性骨髓瘤中Ⅱ期临床的开发,原因就在于显示了视力损害等不良事件。
此外,安进(Amgen)也停止开发一款处于Ⅰ期临床的BCMA-ADC候选药物AMG 224,而且还停止了AMG 420、AMG 701两款BCMA双抗药物,目前管线中已无任何BCMA候选药物。
值得一提的是,这两款BCMA ADC药物都存在明显的副作用。
从ADC结构看,Blenrep的抗体部分为人源化抗B细胞成熟抗原(BCMA)单抗,细胞毒药物为微管抑制剂单甲基auristatin-F(MMAF),连接子为不可切割的半胱氨酸残基的抗蛋白酶马来酰亚胺己酰基(MC)。
虽然在2020年8月美国FDA加速批准了Blenrep作为单药疗法,用于五线治疗难治性多发性骨髓瘤成人患者,但也附带了一个关于眼部毒性的黑框警告,包括严重的视力丧失,ORR为31%(其中CR/sCR率为3%)。
Blenrep最常见的不良反应(≥20%)是角膜病变(眼睛检查时角膜上皮细胞改变)、视力下降、恶心、视力模糊、发热、输液相关反应和疲劳;最常见的3级或4级实验室异常(≥5%)是血小板减少、淋巴细胞减少、血红蛋白减少等。
阿斯利康的MEDI2228是一种类似于GSK的Blenrep的BCMA ADC药物,抗体部分为BCMA的全人源化抗体,细胞毒性部分为吡咯苯并二氮嗪有效载荷(tesirine),一种DNA交联吡咯并苯并二氮杂二聚体,连接子为蛋白酶可裂解二肽(缬氨酸-丙氨酸)。
根据I期临床结果显示,共82例患者接受MEDI2228治疗,在0.14 mg/kg的队列中,≥20%的患者出现治疗相关不良事件,包括畏光(53.7%)、血小板减少(31.7%)、皮疹(29.3%)、γ-谷氨酰转移酶升高(24.4%)、干眼(19.5%)和胸腔积液(19.5%)。
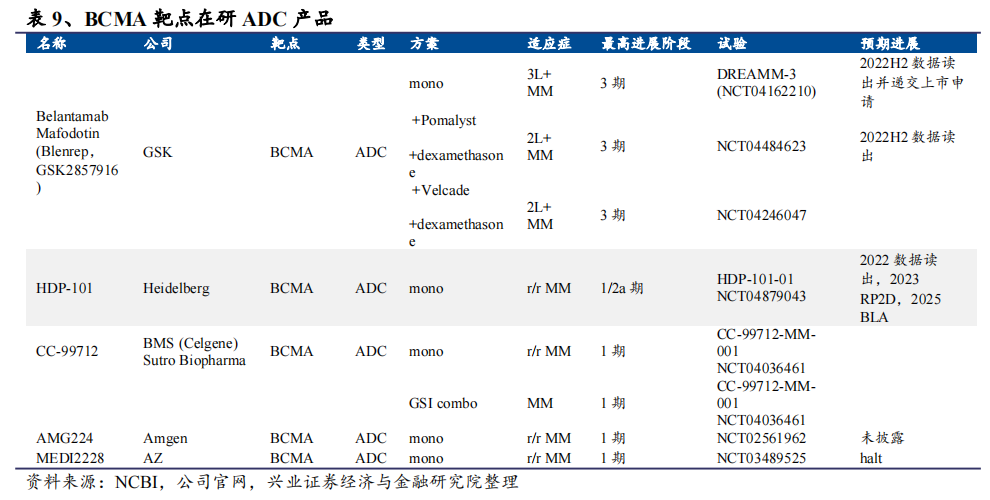
目前,全球在研的BCMA靶点ADC,仅有Heidelberg Pharma的HDP-101、BMS和Sutro Biopharma合作研发的CC-99712等少数几款药物。
其中,HDP-101是华东医药斥资1.05亿欧元购得Heidelberg Pharma共计35%的股权而获得的其中一款在研产品(在中国大陆及港澳台地区、韩国、新加坡等20个亚洲国家和地区的独家许可,包括独家开发及商业化权益)。
根据2022年半年报显示,HDP-101为靶向B细胞成熟抗原(BCMA)的ATAC®药物(抗体-鹅膏蕈碱偶联物),公司合作方德国Heidelberg Pharma目前正在开展该产品用于治疗复发/难治多发性骨髓瘤的海外I/IIa期临床试验,并已于2022年2月15日完成首例受试者给药。
可见,尽管BCMA ADC药物具备一定的差异化优势,但要想研发成功也并非易事。
更何况,BCMA靶点虽然还能应用于开发CAR-T、双抗等热门药物,但临床数据也并不理想。
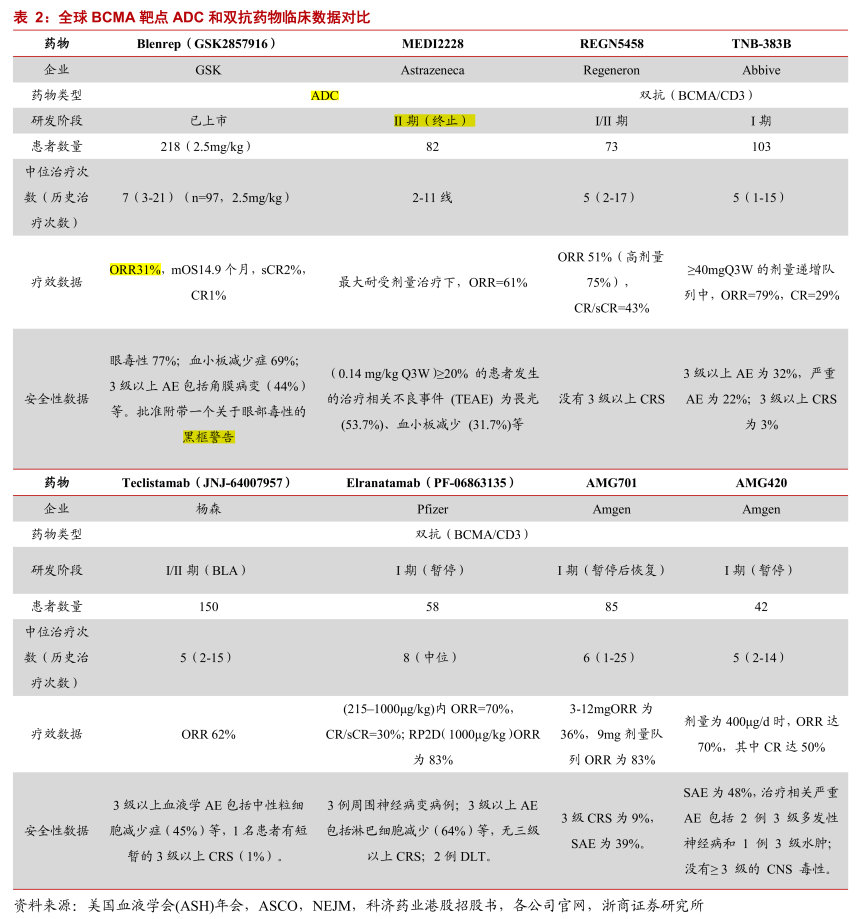
例如,安进的AMG701、艾伯维的TNB-383B、强生的Teclistamab(Tecvayli,JNJ-64007957)等CD3/BCMA双抗均有患者发生3级以上细胞因子释放综合征(CRS);辉瑞的BCMAxCD3双抗Elranatamab,此前因副作用暂停了关键II期患者入组,不良事件包括CRS73%、神经毒性20%,发现3例周围神经病变病例。
不过,强生杨森制药公司的Tecvayli(teclistamab)于2022年8月获得欧盟委员会(EC)批准作为单一疗法用于治疗复发和难治性多发性骨髓瘤(RRMM)成人患者的有条件上市许可,这些患者接受过至少三种治疗线的药物,包括免疫调节剂,蛋白酶体抑制剂和 抗CD38抗体。并且,患者在前次治疗后,其体内肿瘤再次出现进展。
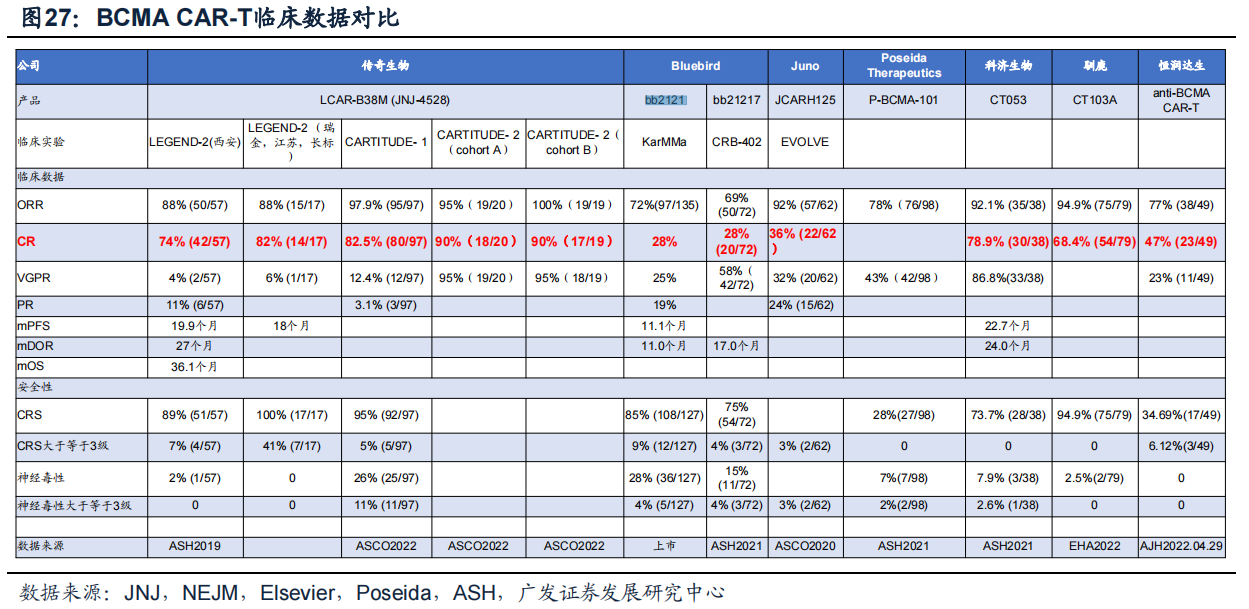
另外,目前全球获批上市的两款CAR-T细胞治疗药物:BMS和Bluebird(蓝鸟生物)联合研发的Abecma(管线编号bb-2121,idecabtagene vicleucel)、传奇生物和强生旗下杨森公司合作开发的Carvykti(西达基奥仑赛,ciltacabtagene autoleucel),虽然ORR均大幅高于GSK的Blenrep,但也存在不良反应。
结语:总体来看,新药研发无疑具备研发投入高、失败率高、风险大的显著特点,但即使成功率不高,无论是开发更多新型药物还是拓展新适应症,靶点的差异化探索之路仍会继续。
参考资料:
1.各公司财报、公告、官网
2.《科济药业-2171.HK-深度报告:实体瘤第一梯队,潜力可期CAR-T龙头》,浙商证券
3.《医药生物行业:新形势下对于创新药投资的思考》,广发证券
不感兴趣
看过了
取消

人点赞

人收藏

打赏
不感兴趣
看过了
取消


















 010-82736610
010-82736610
 股票代码: 872612
股票代码: 872612
 京公网安备 11010802020745号
京公网安备 11010802020745号










